题目内容
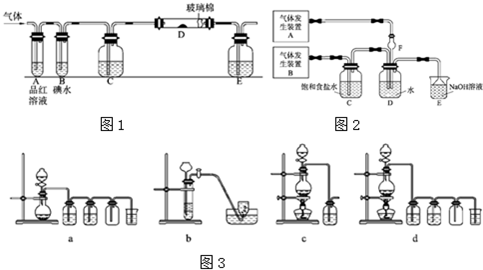
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体与Fe3+反应的主要产物是____、 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。
(15分)
⑴Fe2+、SO42-(2分)
⑵BD(2分)
⑶除去多余的SO2,防止污染空气(2分)
⑷0.25mol/L(3分)
⑸①(1分) SO2、Fe2+都能使酸性高锰酸钾褪色(2分)
⑹B中蓝色退去(1分) I2+SO2+2H2O=4H++2I-+ SO42-(2分)
【解析】
试题分析:⑴Fe3+作氧化剂,SO2作还原剂,故反应产物为Fe2+、SO42-。
⑵A项Na2SO3会被HNO3氧化而得不到SO2; C项固体硫在纯氧中燃烧不好收集气体,故选BD。
⑶装置C的作用是除去多余的SO2,防止污染空气。
⑷NaOH要吸收更多的,SO2,则发生反应为SO2+NaOH=NaHSO3,n(SO2)=0.0125mol,则最少消耗NaOH为0.0125mol,浓度为:0.0125mol÷0.05L=0.25mol/L。
⑸方案①不合理,因为过量的SO2也能还原酸性高锰酸钾,使酸性高锰酸钾褪色
⑹B中蓝色退去; I2+SO2+2H2O=4H++2I-+ SO42-。
考点: 氧化还原反应、化学计算、物质的检验



 生产流程,其流程示意图如下:
生产流程,其流程示意图如下:
