题目内容
在一体积可变的密闭容器中,通入1molN2和3 mol H2,发生反应 ,在t1时刻达到平衡。保持温度和压强不变,在t2时刻,再通入一部分NH3,反应速率(v)与时间(t)的关系曲线正确的是( )
,在t1时刻达到平衡。保持温度和压强不变,在t2时刻,再通入一部分NH3,反应速率(v)与时间(t)的关系曲线正确的是( )
 ,在t1时刻达到平衡。保持温度和压强不变,在t2时刻,再通入一部分NH3,反应速率(v)与时间(t)的关系曲线正确的是( )
,在t1时刻达到平衡。保持温度和压强不变,在t2时刻,再通入一部分NH3,反应速率(v)与时间(t)的关系曲线正确的是( )
C
保持温度和压强不变,在t2时刻,再通入一部分NH3,肯定体积增大,此时氨气浓度增大,氮气、氢气浓度减小,即逆反应速率突然加快,正反应速率突然减慢,故选C

练习册系列答案
相关题目
 CO2(g)+H2(g),一段时间后反应达到平衡。对该反应描述不正确的是
CO2(g)+H2(g),一段时间后反应达到平衡。对该反应描述不正确的是 2HI(g),下列情况一定能说明反应已达到限度的是
2HI(g),下列情况一定能说明反应已达到限度的是 达到平衡的标志是 ( )
达到平衡的标志是 ( ) 2C B. A+B
2C B. A+B 2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
 2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
2AB2(g)(正反应为放热反应),下列各图所表示的变化符合勒夏特列原理的是
 pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=a/15mol·L-1·min-1,C增加了2a/3 mol·L-1,这时,若压缩容器的体积,发现A与C的百分含量不变,则m:n:p:q为
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为:A减少了amol·L-1,B的平均反应速度VB=a/15mol·L-1·min-1,C增加了2a/3 mol·L-1,这时,若压缩容器的体积,发现A与C的百分含量不变,则m:n:p:q为 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。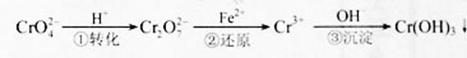

 O
O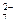
 和CrO
和CrO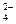 的浓度相同
的浓度相同 ) ="v" (CrO
) ="v" (CrO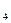 ·7H
·7H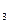 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
 ,要使c(Cr3+)降至10
,要使c(Cr3+)降至10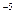 mol/L,溶液的pH应调至 。
mol/L,溶液的pH应调至 。