题目内容
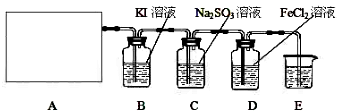
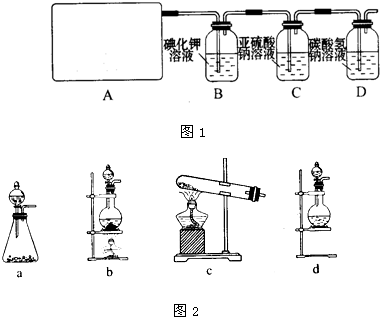
(10分)某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+ 2H2SO4
2H2SO4 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
试回答:
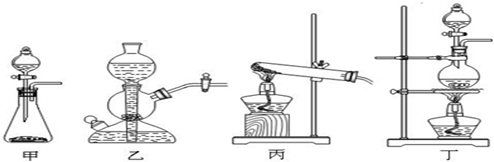
(1)该实验中A部分的装置是 (填写装置的序号)。
(2)请你设计一个实验 ,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):
。
(3)写出D装置中发生反应的离子方程式 。[来源:Z.xx.k.Com]
(4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 ml 溶液,取25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:
(1)b;(2)取C中少量溶液加入足量的稀盐酸,再加入少量BaCl2溶液,若产生白色沉淀,则Na2SO3已有被氧化。
(3)HCO3— + Cl2 = CO2↑ + Cl— + HClO。
(4)Cl2有毒,缺少氯气的尾气吸收装置(氢氧化钠溶液)。
(5)35. 75%
75%
解析

练习册系列答案
相关题目