��Ŀ����
����Ŀ��������п�̸ɵ�ضԻ�����Ⱦ�ܴ�ҵ�Ͽ������¹��ջ������������еĽ���(��������δ����)��
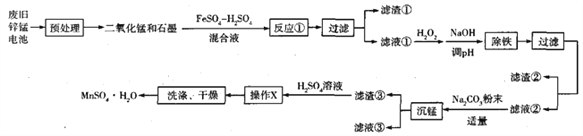
(1)������п�̸ɵ�ضԻ�������ҪΣ����__________�� ![]() ��
��![]() �Ļ��ϼ�Ϊ__________��
�Ļ��ϼ�Ϊ__________��
(2)п�̸ɵ�����Ȼ��Ϊ����ʣ������ʽΪ______________________________��
(3)��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ______________________________��
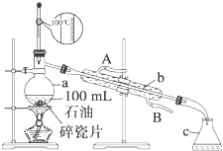
(4)�ù��������ж���õ����ˣ�ʵ�����й�������Ҫ�IJ���������__________��
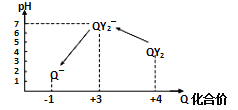
(5)��֪��25��ʱ�� ![]() ����Һ���м���NaOH��Һ��pH=_________ʱ��
����Һ���м���NaOH��Һ��pH=_________ʱ�� ![]() ������ȫ
������ȫ![]() ʱ����Ϊ
ʱ����Ϊ![]() ������ȫ]��
������ȫ]��
(6)д�������̡����������ɼ�ʽ̼����![]() �����ӷ���ʽΪ��______________________________________________________________________��
�����ӷ���ʽΪ��______________________________________________________________________��
(7)�������ữ��![]() ��Һ�����չ�ҵ�����е�
��Һ�����չ�ҵ�����е�![]() ����
����![]() ����֪��Һ��
����֪��Һ��![]() ����Ϊ
����Ϊ![]() ����ҵ������
����ҵ������![]() ����Ϊ
����Ϊ![]() ��
�� ![]() �������ʿɴ�90%������1000
�������ʿɴ�90%������1000![]() ��ҵβ�����ɵõ�
��ҵβ�����ɵõ�![]() ������Ϊ__________kg(�ú���ĸ�Ĵ���ʽ��ʾ)��
������Ϊ__________kg(�ú���ĸ�Ĵ���ʽ��ʾ)��
���𰸡� �ؽ�����Ⱦ����ᡢ�ϼ�ȵ��Һ��Ⱦ +3  1:2 �ձ���©���������� 3
1:2 �ձ���©���������� 3 ![]()
![]() ��
��![]()
��������(1)������п�̸ɵ���е���Ԫ�����ؽ���Ԫ�أ�������ؽ�����Ⱦ����ᡢ�ϼ�ȵ��Һ��Ⱦ�� ![]() ��OΪ-2�ۣ�HΪ+1�ۣ������������ϼ۵Ĵ�����Ϊ0��
��OΪ-2�ۣ�HΪ+1�ۣ������������ϼ۵Ĵ�����Ϊ0�� ![]() �Ļ��ϼ�Ϊ+3�ۣ��ʴ�Ϊ���ؽ�����Ⱦ����ᡢ�ϼ�ȵ��Һ��Ⱦ��+3��
�Ļ��ϼ�Ϊ+3�ۣ��ʴ�Ϊ���ؽ�����Ⱦ����ᡢ�ϼ�ȵ��Һ��Ⱦ��+3��
(2)�Ȼ���������ӻ��������ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)��������ͼ����Ӧ��Ϊ����������������Һ���������������ķ�Ӧ�����ݵ�ʧ�����غ㣬��Ӧ�������������������̣������������������̣��뻹ԭ�������������������ʵ���֮��Ϊ1:2���ʴ�Ϊ��1:2��
(4)��������Ҫ�IJ���������Ҫ���ձ���©�������������ʴ�Ϊ���ձ���©������������
(5) c(OH-)= =
=![]() =10-11 mol/L����c(H+)=10-3 mol/L��pH=3���ʴ�Ϊ��3��
=10-11 mol/L����c(H+)=10-3 mol/L��pH=3���ʴ�Ϊ��3��
(6)��������������̼�����������̷�Ӧ���ɼ�ʽ̼����![]() ��̼����ˮ�������������������������̳�����ٽ�ˮ��ų�������̼����Ӧ�����ӷ���ʽΪ
��̼����ˮ�������������������������̳�����ٽ�ˮ��ų�������̼����Ӧ�����ӷ���ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
(7)�������ữ��MnO2��Һ�����չ�ҵ�����е�SO2����MnSO4��H2O����Ӧ�ķ���ʽΪMnO2+SO2+H2O=MnSO4��H2O��1000![]() ��ҵβ���к��е�SO2�����ʵ���Ϊ
��ҵβ���к��е�SO2�����ʵ���Ϊ![]() =
=![]() mol�������ɵ�MnSO4��H2O�����ʵ���Ϊ
mol�������ɵ�MnSO4��H2O�����ʵ���Ϊ![]() mol��90%=
mol��90%=![]() mol������Ϊ
mol������Ϊ![]() mol��169g/mol=
mol��169g/mol=![]() g=
g=![]() kg���ʴ�Ϊ��
kg���ʴ�Ϊ�� ![]() ��
��

 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�����Ŀ����ͼ1��ijͬѧ��ʵ�����н������ȷ�Ӧ(������)��ʵ��װ�ã�ʵ�������۲쵽������֮һΪ��ֽ©�����²����մ���������������ɳ������

��1��д���÷�Ӧ�Ļ�ѧ����ʽ��________________________________________________��
��2��Ϊ�������ȷ�Ӧ��Ĺ���ɷ֣�����д�±���
����ɷ� | �������� | ʵ����������� |
�� | ____________ | ___________ |
������ | _____________ | ____________ |
��3��̽�����ȷ�Ӧ���������ʣ�����Ӧ�������еĹ�����������ձ��У�����һ����ϡ���ᣬ������ȫ�ܽ⣬��Ӧ������������ų�(���ý����ɰ�ϡHNO3)��ԭΪNH4NO3)���ڷ�Ӧ�����Һ�л����μ�4 mol��L��1��NaOH��Һ���������������ʵ���(mol)�����NaOH��Һ�����(ml)�Ĺ�ϵ��ͼ2��ʾ��
��1д��DE�η�����Ӧ�����ӷ���ʽ��_____________________________________________��
��B��A�IJ�ֵΪ_______________________________________________________________��