题目内容
Ⅰ. 在实验室利用下列装置,可制备某些气体并验证其化学性质。
完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | _________________ | _________________ |
| (2) | 乙炔 | A→C→E | _________________ |
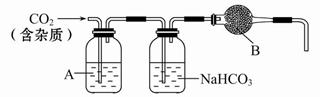
经查阅有关资料得知H2S、PH3能与硫酸铜溶液反应,相关仪器和药品装置图如下:

(1)按气体从左到右的流向选择最佳的装置组合是(选填字母序号):_________
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是________________。
(3)若电石样品的质量为m1g,F吸收乙炔前后的质量差为m2g,则电石样品中CaC2质量分数
 =_______________。
=_______________。
(12分,每空2分)Ⅰ.(1)B→D→E 


(2)


Ⅱ. (1)A、B、D、E、F;(2)饱和食盐水 (3)
解析试题分析:Ⅰ.①实验室制取乙烯利用的是乙醇在浓硫酸的作用下加热到170℃通过消去反应制备乙烯。由于生成的乙烯中含有SO2,所以在通过酸性高锰酸钾溶液检验乙烯的性质之前,要首先除去SO2,所用试剂是氢氧化钠溶液,即连接顺序是B→D→E ,反应的方程式是

 。
。
②实验室制取乙炔,利用的是电石和饱和食盐水反应制备,反应的方程式是

 。
。
Ⅱ. (1)测定电石样品的纯度,则可以通过测量电石与水反应生成的乙炔来完成。由于乙炔能被溴的四氯化碳溶液吸收,通过称量反应前后的质量即可得出生成的乙炔质量。但由于生成的乙炔气体中含有H2S和PH3,所用需要分别通过浓硫酸和硫酸铜除去。又因为装置中含有没有被完全排出的气体,因此还需要借助于A装置,因此正确的连接顺序是A、B、D、E、F。
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是饱和食盐水。
(3)F吸收乙炔前后的质量差为m2g,则生成的乙炔质量就是m2g,所用根据方程式可知碳化钙的质量是 ,因此电石样品中CaC2质量分数
,因此电石样品中CaC2质量分数 =
= 。
。
考点:考查乙烯、乙炔的实验室制备、电石纯度测定的实验探究
点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

选用适当装置、试剂和方法可制备中学化学中的几种常见气体。请填写表中的空格(从①~⑩中选择,填序号):
| 实验 | 气体 | 所用装置 | 气体性质 | 干燥该气体选用的试剂 |
| (1) | | ③ | 其水溶液显碱性 | |
| (2) | | | 1mol最多能与2molH2反应 | ⑩ |

⑤Cl2 ⑥C2H2
⑦C2H4 ⑧NH3
⑨碱石灰 ⑩浓H2SO4
下列实验操作不能达到预期实验目的的是
| | 实验目的 | 实验操作 |
| A | 鉴别乙酸乙酯和乙酸 | 分别加入饱和Na2CO3溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 比较H2O和乙醇中羟基氢的活泼性 | 分别加入少量Na |
| D | 比较I2在H2O和CCl4中的溶解度 | 向I2水中加入CCl4,振荡 |
下图所示的实验,能达到实验目的的是
| A | B | C | D |
 |  |  |  |
| 验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生析氢腐蚀 | 验证非金属性Cl> C > Si |
下列对实验现象的解释与结论,正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了变性 |
| B | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀产生 | 该溶液中一定含有SO42- |
| C | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等 |


 )__________________________________。
)__________________________________。
 2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
