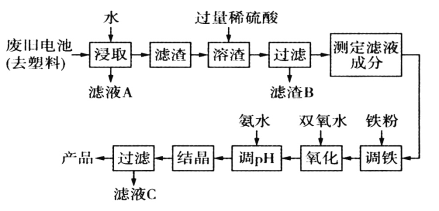
题目内容
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。
(1)在标准状态下,由元素最稳定的单质生成1mol纯化合物时的反应热称为该化合物的标准摩尔生成焓。各物质的标准摩尔生成焓如表:

则制备合成气的反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
2CO(g)+2H2(g)在标准状态下的反应热ΔH=___kJ/mol。
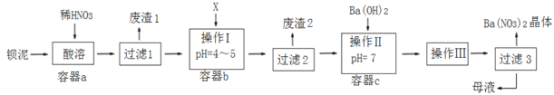
(2)在刚性容器中,当投料比![]() =1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
=1.0时,CO2的平衡转化率(α)与温度(T)、初始压强(p)的关系如图所示。
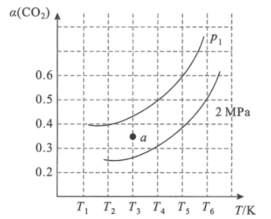
①由图可知:压强P1___2MPa(填“>”、“<”或“=”),理由是___。
②当温度为T3、压强为p1时,a点的v正___v逆(填“>”、“<”或“=”)。
③若起始时提高投料比![]() ,则CO2的平衡转化率将___(填“升高”或“降低”)。
,则CO2的平衡转化率将___(填“升高”或“降低”)。
④起始时向容器中加入1molCH4和1molCO2,在温度为T6。、初始压强为2MPa时反应,该反应的Kp=___(MPa)2。
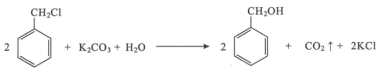
(3)该催化重整过程中有副产物碳生成,碳的积累会严重影响催化剂的活性。某研究小组计算和模拟实验表明积碳量(催化剂表面碳的质量与催化剂的质量之比)与投料比、温度的关系如图。
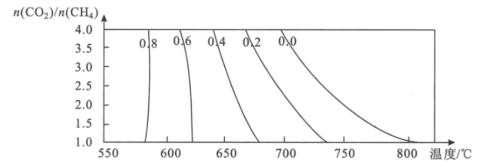
当投料比![]() =2.0时,要使积碳量最小,应调节温度为___℃。
=2.0时,要使积碳量最小,应调节温度为___℃。
【答案】+247 < 该正反应气体分子数增加,其它条件相同时,减小压强,平衡正向移动,CO2的平衡转化率增大 > 升高 4 750
【解析】
(1)ΔH=生成物的标准摩尔生成焓和-反应物的标准摩尔生成焓和;
(2)①在恒温条件下,压强增大,平衡向气体总物质的量减小的方向移动;
②当温度为T3、压强为p1时,a点在曲线下方,未达到平衡,且平衡状态时,CO2的转化率增大;
③起始时提高投料比![]() ,即增大n(CH4)的量,平衡正向进行;
,即增大n(CH4)的量,平衡正向进行;
④起始时向容器中加入1molCH4和1molCO2,在温度为T6,初始压强为2MPa时反应,达到平衡时CO2的转化率为50%,则:
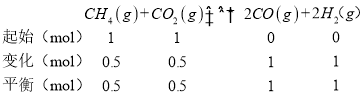
平衡时CH4和CO2的体积分数均为![]() ,CO和H2的体积分数均为
,CO和H2的体积分数均为![]() ,Kp=
,Kp=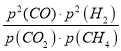 ;
;
(3)结合积碳量与投料比、温度的关系图分析当碳积量最小时,选择温度调节范围。
(1)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)在标准状态下的反应热ΔH=(-111kJ/mol)×2-(-75kJ/mol)- (-394kJ/mol)=+ 247kJ/mol;
2CO(g)+2H2(g)在标准状态下的反应热ΔH=(-111kJ/mol)×2-(-75kJ/mol)- (-394kJ/mol)=+ 247kJ/mol;
(2)①已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的正反应气体分子数增加,在恒温条件下,减小压强,平衡正向移动,CO2的平衡转化率增大,即压强P1<2MPa;
2CO(g)+2H2(g)的正反应气体分子数增加,在恒温条件下,减小压强,平衡正向移动,CO2的平衡转化率增大,即压强P1<2MPa;
②当温度为T3、压强为p1时,a点趋于平衡状态时,CO2的转化率增大,说明此时向正反应方向进行,即v正>v逆;
③起始时提高投料比![]() ,即增大n(CH4)的量,平衡正向进行,则CO2的平衡转化率将升高;
,即增大n(CH4)的量,平衡正向进行,则CO2的平衡转化率将升高;
④起始时向容器中加入1molCH4和1molCO2,在温度为T6,初始压强为2MPa时反应,达到平衡时CO2的转化率为50%,则:
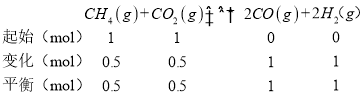
平衡时CH4和CO2的体积分数均为![]() ,CO和H2的体积分数均为
,CO和H2的体积分数均为![]() ,平衡时总压强p=2Mp×
,平衡时总压强p=2Mp×![]() =3 Mp,则Kp=
=3 Mp,则Kp= 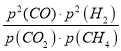 =
= 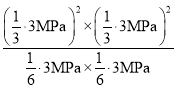 =4(MPa)2;
=4(MPa)2;
(3)当投料比![]() =2.0时,要使积碳量最小,根据积碳量与投料比、温度的关系图可知,应调节温度在750℃左右。
=2.0时,要使积碳量最小,根据积碳量与投料比、温度的关系图可知,应调节温度在750℃左右。

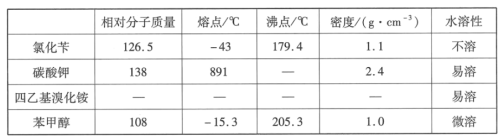
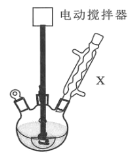
【题目】下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
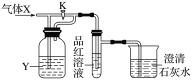
选项 | A | B | C | D |
X | CO | SO2 | CO2 | Cl2 |
Y | 浓H2SO4 | NaHCO3饱和溶液 | Na2SO3溶液 | NaHSO3饱和溶液 |
A.AB.BC.CD.D