题目内容
 某化学活动小组利用如图探究金属腐蚀原理,将装置放置一段时间,下列有关叙述错误的是( )
某化学活动小组利用如图探究金属腐蚀原理,将装置放置一段时间,下列有关叙述错误的是( )| A、生铁块中的碳是原电池的正极 | B、红墨水柱两边液左高右低 | C、a、b中生铁均发生电化腐蚀 | D、a管中溶液pH升高,b管中pH降低 |
分析:氯化钠溶液呈中性,氯化铵溶液呈酸性,生铁中含有碳和铁,碳、铁和电解质溶液构成原电池,铁作负极,碳作正极,在中性电解质溶液中铁易发生吸氧腐蚀,在酸性溶液中铁发生析氢腐蚀.
解答:解:A.碳、铁和氯化钠溶液或氯化铵溶液都能构成原电池,铁易失电子发生氧化反应作负极,碳作正极,故A正确;
B.a中电解质溶液呈中性,铁发生吸氧腐蚀,b中电解质溶液呈酸性,铁发生析氢腐蚀,所以b中气体压强增大,a中气体压强减小,则红墨水从右向左移动,则红墨水水柱左高右低,故B正确;
C.a、b装置都符合原电池构成条件,所以都能构成原电池,则铁发生电化学腐蚀,故C正确;
D.a中发生吸氧腐蚀,负极上铁失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,b中铁发生析氢腐蚀,正极上氢离子得电子生成氢气,则溶液中氢离子浓度减小,pH增大,故D错误;
故选D.
B.a中电解质溶液呈中性,铁发生吸氧腐蚀,b中电解质溶液呈酸性,铁发生析氢腐蚀,所以b中气体压强增大,a中气体压强减小,则红墨水从右向左移动,则红墨水水柱左高右低,故B正确;
C.a、b装置都符合原电池构成条件,所以都能构成原电池,则铁发生电化学腐蚀,故C正确;
D.a中发生吸氧腐蚀,负极上铁失电子生成亚铁离子,正极上氧气得电子生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,b中铁发生析氢腐蚀,正极上氢离子得电子生成氢气,则溶液中氢离子浓度减小,pH增大,故D错误;
故选D.
点评:本题考查了金属腐蚀与防护,明确铁发生析氢腐蚀与吸氧腐蚀的条件是解本题关键,再结合电极上发生的反应来分析解答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
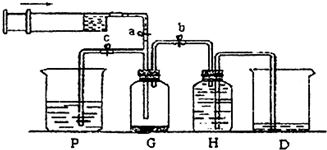
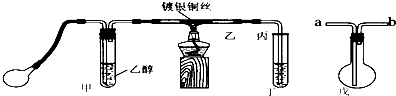 某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白:
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白: