题目内容
氮有多种氧化物,其中N2O5是一种新型硝化剂,其性质和制备收到人们的关注.
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将 (填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为 .
③一定温度下,在2L恒容密闭容器中加入2mol N2O5,达到平衡时,气体的压强为原来的
,(不考虑NO2聚合成N2O4),则N2O5的转化率a1= ,该温度下反应的平衡常数K= .
(2)如图1所示装置可用于制备N2O5,则N2O5在电解池的 区生成,其电极反应式为 .
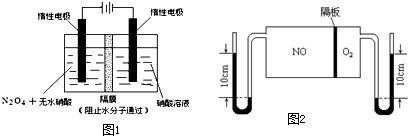
(3)如图2:V(NO):V(O2)=3:1.当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态).当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm.假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为 .
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氩气,则N2O5的转化率将
②如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
③一定温度下,在2L恒容密闭容器中加入2mol N2O5,达到平衡时,气体的压强为原来的
| 3 |
| 2 |
(2)如图1所示装置可用于制备N2O5,则N2O5在电解池的

(3)如图2:V(NO):V(O2)=3:1.当抽去NO和O2之间的隔板后,NO和O2反应后成NO2,部分NO2聚合成N2O4(N2O4此时为气态).当体系达到平衡后,U形毛细管两端汞面高度差由反应前10cm变为7.1cm.假设温度不变,且隔板及U形毛细管的体积都忽略不计,此时混合气体的平均相对分子质量为
考点:化学平衡的计算,电解原理
专题:化学平衡专题,电化学专题
分析:(1))①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,根据v=
计算N2O5的分解速率;
③根据
=
列式计算出达到平衡时总的物质的量,然后根据差量法计算出达到平衡时各组分的物质的量、浓度,最后根据转化率、平衡常数表达式进行计算.
(2)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成;
(3)设出一氧化氮和氧气的物质的量及二氧化氮的转化率,然后根据
=
列式计算出二氧化氮转化率,最后计算出混合气体的平均相对分子质量.
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,根据v=
| △c |
| △t |
③根据
| P(平衡) |
| P(初始) |
| n(平衡) |
| n(初始) |
(2)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成;
(3)设出一氧化氮和氧气的物质的量及二氧化氮的转化率,然后根据
| P(平衡) |
| P(初始) |
| n(平衡) |
| n(初始) |
解答:
解:(1))①恒温恒容下,通入氮气,反应混合物个组分的浓度不变,平衡不移动,N2O5的转化率不变,
故答案为:不变;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为
=0.00296 mol?L-1?s-1,
故答案为:0.00296 mol?L-1?s-1;
③恒温恒容条件下,压强之比等于气体的物质的量之比,即:
=
,气体的压强为原来的
,则说明反应后气体的物质的量为:2mol×
=3mol,根据差量法可得:
2N2O5(g)?4NO2(g)+O2(g),△n
2 4 1 3
mol
mol
mol 1mol
则N2O5的转化率a1=
×100%≈33.3%;
达到平衡时五氧化二氮的浓度为:
=
mol/L,二氧化氮的浓度为:
=
mol/L,氧气的浓度为:
=
mol/L,
则该温度下反应的平衡常数K=
=
=
,
故答案为:33.3%;
;
(2)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-=2N2O5+2H+;
(3)设反应前NO为3 mol,O2为1 mol,NO2转化率为x
则:2NO+O2 =2NO2,
2 1 2
2mol 1mol 2mol
平衡时二氧化氮的物质的量为2x,
则:2NO2 ?N2O4,
反应前:2mol 0
转化:2xmol xmol
平衡时:2(1-x)mol xmol
平衡时气体的总物质的量为:n(NO)+n(NO2)+n(N2O4)=1mol+2mol-2xmol+xmol=(3-x)mol,
所以T、V恒定时,
=
,
则
=
,
解得:x=0.16,平衡时气体的总物质的量为:3mol-0.16mol=2.84mol,
所以混合气体的平均相对分子质量为:
≈43.0,
故答案为:43.0.
故答案为:不变;
②由图可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为
| 1.48mol/L |
| 500s |
故答案为:0.00296 mol?L-1?s-1;
③恒温恒容条件下,压强之比等于气体的物质的量之比,即:
| P(平衡) |
| P(初始) |
| n(平衡) |
| n(初始) |
| 3 |
| 2 |
| 3 |
| 2 |
2N2O5(g)?4NO2(g)+O2(g),△n
2 4 1 3
| 2 |
| 3 |
| 4 |
| 3 |
| 1 |
| 3 |
则N2O5的转化率a1=
| ||
| 2mol |
达到平衡时五氧化二氮的浓度为:
2mol-
| ||
| 2L |
| 2 |
| 3 |
| ||
| 2L |
| 2 |
| 3 |
| ||
| 2L |
| 1 |
| 6 |
则该温度下反应的平衡常数K=
| c(O2)?c(NO2)4 |
| c(N2O5)2 |
(
| ||||
(
|
| 2 |
| 27 |
故答案为:33.3%;
| 2 |
| 27 |
(2)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-=2N2O5+2H+;
(3)设反应前NO为3 mol,O2为1 mol,NO2转化率为x
则:2NO+O2 =2NO2,
2 1 2
2mol 1mol 2mol
平衡时二氧化氮的物质的量为2x,
则:2NO2 ?N2O4,
反应前:2mol 0
转化:2xmol xmol
平衡时:2(1-x)mol xmol
平衡时气体的总物质的量为:n(NO)+n(NO2)+n(N2O4)=1mol+2mol-2xmol+xmol=(3-x)mol,
所以T、V恒定时,
| P(平衡) |
| P(初始) |
| n(平衡) |
| n(初始) |
则
| 3-x |
| 4 |
| 7.1 |
| 10 |
解得:x=0.16,平衡时气体的总物质的量为:3mol-0.16mol=2.84mol,
所以混合气体的平均相对分子质量为:
| 30×3+32×1 |
| 2.84 |
故答案为:43.0.
点评:本题为拼合型,涉及化学反应速率计算、化学平衡移动与计算、平衡常数的计算与运用、电解原理等,题目难度较大,题量大、计算量较大,是对学生心理素质的考验,注意掌握平衡常数在化学平衡计算的运用,(3)为难点和易错点,注意掌握计算方法.

练习册系列答案
相关题目
香兰素具有浓郁芳香,若1m3空气中含有1×10-9mg就能嗅到其特征香气.由愈创木酚合成香兰素,在国外已有近百年的历史.愈创木酚的结构简式是 ,在它的同分异构体中,只能被看做酚类(含2个酚羟基)的有( )
,在它的同分异构体中,只能被看做酚类(含2个酚羟基)的有( )
 ,在它的同分异构体中,只能被看做酚类(含2个酚羟基)的有( )
,在它的同分异构体中,只能被看做酚类(含2个酚羟基)的有( )| A、3种 | B、6种 | C、8种 | D、10种 |
下列属于水解反应的是( )
| A、CO32-+H2O?HCO3-+OH- |
| B、Al3++3OH-=Al(OH)3↓ |
| C、HCO3-+H2O?CO32-+H3O+ |
| D、H2O+H2O?OH-+H3O+ |
下列说法正确的是( )
| A、在化学反应中,化学能只可以转化为热能 |
| B、合成氨工业中使用铁作催化剂以改变该反应的限度 |
| C、SO2和O2合成SO3的反应中,增大压强,该反应速率减小 |
| D、化学键的断裂和形成是化学反应中能量变化的主要原因 |
下列反应中,属于氧化还原反应但不属于置换反应的是( )
A、SiO2+CaCO3
| ||||
B、3Mg+2NH3
| ||||
C、Fe3O4+4CO
| ||||
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |