题目内容
【题目】三氯化硼的熔点为-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2=2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
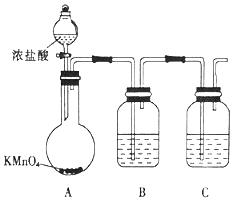
①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
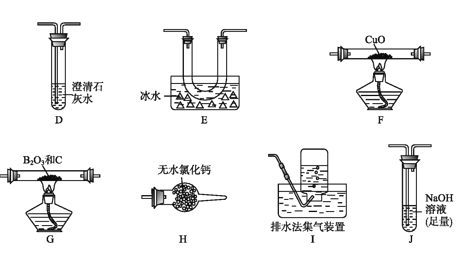
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→___________→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“F”或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤若实验中制取得到了11.75g BCl3,则理论上消耗12 mol/L的浓盐酸的体积为_________mL(保留一位小数)
【答案】 饱和食盐水 干燥氯气 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O EHJH 装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊 G BCl3+3H2O=H3BO3+3HCl 40.0
【解析】(1)①因浓盐酸有挥发性,在A中反应生成的氯气中含有氯化氢、水蒸气杂质,为得到纯净干燥的氯气需将气体经饱和食盐水吸收氯化氢气体,再经浓硫酸吸水后得到纯净干燥的氯气;故装置B中盛放的试剂是饱和食盐水,装置C的作用是干燥氯气;②装置A中发生反应的离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)①氯气在G中反应:B2O3+3C+3Cl2=2BCl3+3CO,生成的三氯化硼的沸点为12.5℃,故生成的三氯化硼需要经冷凝装置(E)变成非气体,便于三氯化硼与CO、Cl2的分离;若不除去氯气,则氯气通入澄清石灰水与之反应,就无法证明一氧化碳还原氧化铜后的产物,故气流经冷凝后要除去氯气,又因为三氯化硼易水解生成硼酸(H3BO3),故冷凝后气流先通入H,再通入J,这样做的目的是防止J中的水蒸气进入H,最后气流再经干燥(H)后进入F,故顺序为A→B→C→G→E→H→J→H→F→D→I。②一氧化碳还原氧化铜,生成的二氧化碳气体通入澄清石灰水,产生的现象是装置F中黑色粉末变为红色,装置D中澄清石灰水变浑浊。③因一氧化碳是可燃性气体,在还原氧化铜之前应排除仪器中的空气,防止爆炸,故应在G处先加热,使产生的一氧化碳在仪器中通一段时间,排尽空气,然后再在F处加热(类似初中学过的一氧化碳还原氧化铜实验)。
④水解反应可以看作中和反应逆反应,BCl3水解的化学方程式为BCl3+3H2O=H3BO3+3HCl;
⑤11.75g BCl3的物质的量为0.1mol,由反应:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O,B2O3+3C+3Cl2=2BCl3+3CO,可找到关系式如下:48HCl—15Cl2↑—10BCl3,n(HCl)=0.48mol,v(HCl)=n/c=0.48mol/12mol/L=40.0mL。

 阅读快车系列答案
阅读快车系列答案