题目内容
铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+。请分析下图,回答有关问题。
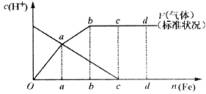
(1)假设在任一气体产生的曲线段内只有一种还原产物,试配平由b点到c点时反应的化学方程式:
□Fe+□HNO3——□Fe(NO3)3+□□+□H2O
(2)判断从O点到a点时的还原产物,应为_______。
(3)a点到b点时产生还原产物为_______,其原因是_______。
(4)已知到达d点时反应完全结束,此时溶液中的主要阳离子为_______。分析投入金属铁的物质的量之比![]() =_______。
=_______。
答案:
解析:
提示:
解析:
(1)8、30,8、3 NH4NO3、9 (2)NO (3)N2O;反应放热,温度升高,生成N2O (4)Fe2+、2/3
|
提示:
从b到c,氢离子浓度几本不变,可认为HNO3浓度已经非常稀了,故产物应该是NH4NO3,然后通过得失电子守恒配平氧化还原方程。从0到a,是冷的稀硝酸与铁反应,而从a到b,由于0到a的反应不断放热,溶液温度升高,可认为是热的稀硝酸与铁反应。
|

练习册系列答案
相关题目
 铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+.请分析下图,回答有关问题.
铁在热的稀HNO3中反应,其主要还原产物为N2O,而在冷的稀HNO3中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+.请分析下图,回答有关问题. 。请分析下图,回答有关问题。
。请分析下图,回答有关问题。 


