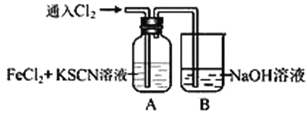
题目内容
【题目】相对分子质量为112的有机物X完全燃烧只生成CO2和H2O,若X含一个六元碳环且可以发生银镜反应,则环上一溴代物的种类为( )
A.2
B.3
C.4
D.5
【答案】C
【解析】解:若X含一个六元碳环且可以发生银镜反应,则X中含有﹣CHO,有机物X完全燃烧后只生成二氧化碳和水,说明没有碳氢氧以外的元素,X的相对分子质量为112,X含有一个六碳环,6个碳原子式量为72,﹣CHO的式量为29,故分子含有1个﹣CHO,利用残余法可知,剩余基团或原子的总式量为112﹣72﹣29=11,故还原11个H原子,A的结构简式为 ![]() ,环上的取代物,除了﹣CHO的邻、间、对位置外,醛基连接的碳也还有氢原子,可以取代,故其环上的一溴代物有4种,
,环上的取代物,除了﹣CHO的邻、间、对位置外,醛基连接的碳也还有氢原子,可以取代,故其环上的一溴代物有4种,
故选C.

练习册系列答案
相关题目
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢,设计方案中一组数据如表:
编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
浓度/(molL﹣1) | 体积/mL | 浓度/(molL﹣1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4 , 标况下,每生成89.6LCO2气体,转移mol电子.写出H2C2O4与酸性KMnO4溶液反应的离子方程式 .
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=molL﹣1min﹣1 .