��Ŀ����
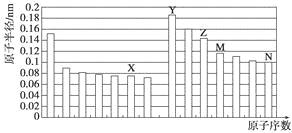
����Ŀ��A��B��C��D��E��Ϊ����������Ԫ�أ���ԭ������������������AԪ��ԭ�Ӻ���ֻ��һ�����ӣ�A��C��B��D�ֱ�ͬ���壻B��D��Ԫ��ԭ������֮����A��C��Ԫ��ԭ������֮�͵�2����
��ش��������⣺
��1��������Ԫ����ɵ��������������ڷǵ���ʵ���________(����ĸ)��
A��C2B2 B��DB2 C��E2 D��C2DB3
��2��DԪ����Ԫ�����ڱ��е�λ��Ϊ_______________________________��������C2B���������ӵİ뾶��С��ϵΪ________��________(�����ӷ���)��
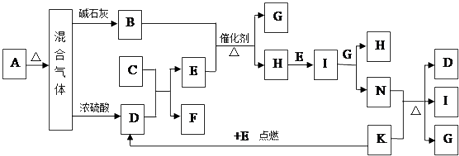
��3��ʵ��������ѡ������װ����ȡ���ռ����������E2���塣ʵ����Ӧѡ�õ�װ��Ϊ________________(�������ҵ�����˳����д)��
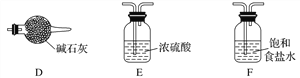
���𰸡� B �������ڢ�A�� O2�� Na�� AFEB
��������AԪ��ԭ�Ӻ���ֻ��1�����ӣ���AΪHԪ�أ�A��Cͬ���壬��CΪNaԪ�أ�B��Dͬ���壻B��D��Ԫ��ԭ������֮����A��C��Ԫ��ԭ������֮�͵�2������B��D�ֱ�ΪO��SԪ�أ�A��B��C��D��E��Ϊ����������Ԫ�أ���ԭ����������������EΪClԪ�ء�
��1��A��C2B2Ϊ�������ƣ��ǵ���ʣ�A����B��DB2 ΪSO2�����ڷǵ���ʣ�B��ȷ��C��E2�����������ǵ���ʣ�Ҳ���Ƿǵ���ʣ�C����D��C2DB3ΪNa2SO3�����ڵ���ʣ�D����ѡB����2��DԪ��ΪS����Ԫ�����ڱ���λ�ڵ�3���ڢ�A�壻������C2BΪNa2O�����е���������ΪNa+��O2�������Ų���ͬ��ԭ������Խ�����Ӱ뾶ԽС������O2�뾶����Na+�뾶����3��ʵ������MnO2��Ũ���������ȡCl2������װ��ΪA����ȡ��Cl2�к���HCl��ˮ�֣���������F��ȥHCl��������E��ȥˮ�֣��������B���ռ�Cl2������β������ѡ�õ�װ������ΪAFEB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g��+H2��g��CO��g��+H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
��2����Ӧ����Ӧ����ѡ����ȡ������ȣ���
��3�����жϸ÷�Ӧ�Ƿ�ﵽ��ѧƽ��״̬�������� ��
a��������ѹǿ���� b�����������c��CO������
c��v����H2��=v����H2O�� d��c��CO2��=c��CO��
��4��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��c��CO2��c��CH2��=c��CO��c��H2O�������жϴ�ʱ���¶�Ϊ��