��Ŀ����
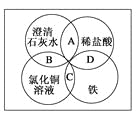
����Ŀ��ij��ѧ��ȤС���Ϊ̽��Fe3+�Ƿ�������SO2 �� �������ͼʵ��װ�ã� 
��1������ͼ���Ӻ�װ�ã�ʵ��ǰӦ��������
��2���۲쵽װ��C�в����˰�ɫ������ͬѧ����������²��루ÿ������ֻ����һ�����ʵ������ԣ���
����1����
����2��SO2��Fe3+�����ˣ�
����3��SO2��NO3��������
��3����ͬѧ��Ϊ����1��ȷ������������װ��A�������ų����ŵ�̽��ʵ�飮
��ͬѧ��Ϊ����2��ȷ����װ��C�з�Ӧ�����ӷ���ʽ��
��4����ͬѧ��Ϊ����3��ȷ�������ü�ͬѧ��ʵ��װ�ã����ʵ����֤���룮���ڱ�����д��ʵ�鲽���Լ�Ԥ������ͽ��ۣ���ѡʵ���Լ���NaNO3��Һ��KSCN��Һ��FeCl3��Һ��BaCl2��Һ��Fe��NO3��3��Һ
ʵ�鲽�� | Ԥ������ͽ��� |
���𰸡�
��1�����װ�õ�������
��2��������SO2����H2O�У������Ѷ�����������������H2SO4
��3��SO2+2Fe3++Ba2++2H2O=BaSO4��+2Fe2++4H+
��4����װ��C�е���Һ��ΪNaNO3 ��BaCl2�Ļ����Һ��Ȼ���Һ©���������з�Ӧ����Ӧһ��ʱ�����C�г��ְ�ɫ��������֤������3��ȷ
���������⣺��1.����װ�����������װ�õ������ԣ����Դ��ǣ����װ�õ������ԣ�
��2.������2��SO2��Fe3+�����ˣ�����3��SO2��NO3�������ˣ�װ���к��е������������������ʿ��ܱ��������������Դ��ǣ�������SO2����H2O�У������Ѷ�����������������H2SO4��
��3.�����۵�2��װ��B�з�Ӧ�����ӷ���ʽ��SO2+2Fe3++Ba2++2H2O=BaSO4��+2Fe2++4H+ �� ���Դ��ǣ�SO2+2Fe3++Ba2++2H2O=BaSO4��+2Fe2++4H+��
��4.����ͬѧ�۵�����SO2��NO3����Ӧ�������NaNO3��Һ��BaCl2��Һ����BaCl2��Һ��Fe��NO3��3��Һ���ɣ��������Ϊ����װ��C�е���Һ��ΪNaNO3 ��BaCl2�Ļ����Һ����Ӧһ��ʱ�����C�г��ְ�ɫ��������֤������3��ȷ�����Դ��ǣ�
ʵ�鲽�� | Ԥ������ͽ��� |
��װ��C�е���Һ��ΪNaNO3 ��BaCl2�Ļ����Һ�� | ��Ӧһ��ʱ�����C�г��ְ�ɫ��������֤������3��ȷ |

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��±��Ԫ�صĵ��ʺͻ�����ܶ࣬���ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ���������ǣ�
��1��±��Ԫ��λ��Ԫ�����ڱ������� ��ļ۵����Ų�ʽΪ ��
��2����һ��Ũ�ȵ���Һ�У���������Զ����ӵϣ�HF�� 2 ��ʽ���ڵģ�ʹ�������ӵϵ��������� ��
��3��������±��ṩ�ĵ�һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ�����������ƣ���
�� | �� | �� | �� | |
��һ�����ܣ�kJ/mol�� | 1681 | 1251 | 1140 | 1008 |
��4����֪���ᣨHIO3���ߵ��ᣨH5IO6���Ľṹ�ֱ���ͼI��II ��ʾ�� 
��Ƚ϶�������ǿ����HIO3H5IO6�����������������=������
��5���Է��� ClO2��������ԭ�ӵ��ӻ����� �� ��д��һ�� ClO3���ĵȵ����� ��
��6��ͼ1Ϊ�⾧�徧���ṹ���й�˵������ȷ���� ��
A.����ӵ�������2�ֲ�ͬ��ȡ��2��ȡ��ͬ�ĵ������4��λ��������λ�γɲ�ṹ
B.�þ�̯����֪ƽ��ÿ����������4����ԭ��
C.�⾧��Ϊ��������Ŀռ�ṹ����ԭ�Ӿ���
D.�⾧���д��ڵ�������зǼ��Լ��ͷ��»���
��7����֪CaF2���壨��ͼ2�����ܶ�Ϊ��g/cm3 �� NAΪ�����ӵ��������������ڵ�����Ca2+�ĺ˼��Ϊa cm����CaF2����Է����������Ա�ʾΪ ��