题目内容
 国家实验室一个研小组发现首例带结晶水的晶体在 5K 下呈现超导性.据报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子).下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( )
国家实验室一个研小组发现首例带结晶水的晶体在 5K 下呈现超导性.据报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子).下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( )A、 |
B、 |
C、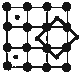 |
D、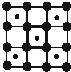 |
考点:晶胞的计算
专题:化学键与晶体结构
分析:根据均摊法计算粗线画出的CoO2层状结构的晶胞的钴原子和氧原子的个数,据此作判断.
解答:
解:A、CoO2层状结构的晶胞中含有Co原子数为1,含有O原子数为4×
=2,所以Co原子与O原子数之比为1:2,故A正确;
B、CoO2层状结构的晶胞中含有Co原子数为1+4×
=2,含有O原子数为4,所以Co原子与O原子数之比为1:2,故B正确;
C、CoO2层状结构的晶胞中含有Co原子数为4×
=1,含有O原子数为4×
=2,所以Co原子与O原子数之比为1:2,故C正确;
D、CoO2层状结构的晶胞中含有Co原子数为1,含有O原子数为4×
=1,所以Co原子与O原子数之比为1:1,故D错误;
故选D.
| 1 |
| 2 |
B、CoO2层状结构的晶胞中含有Co原子数为1+4×
| 1 |
| 4 |
C、CoO2层状结构的晶胞中含有Co原子数为4×
| 1 |
| 4 |
| 1 |
| 2 |
D、CoO2层状结构的晶胞中含有Co原子数为1,含有O原子数为4×
| 1 |
| 4 |
故选D.
点评:本题考查了均摊法,难度较小,解题的关键在于仔细看清每个示意图中代表钴原子和氧原子的点.

练习册系列答案
相关题目
香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
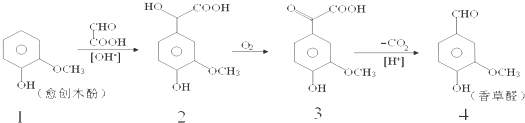
下列说法正确的是( )

下列说法正确的是( )
| A、反应1→2中原子利用率为90% |
| B、检验制得的香草醛中是否混有化合物3,可用氯化铁溶液 |
| C、化合物2在一定条件下可发生酯化反应 |
| D、等物质的量四种化合物分别与足量NaOH溶液反应,消耗NaOH物质的量之比1:4:3:2 |
X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的最外层电子数是次外层的两倍,也是X、W最外层电子数之和的两倍,Z是地壳中含量最多的元素,R的单核离子在同周期元素形成的单核离子中半径最小.以下说法中正确的是( )
| A、R形成的盐一定不能与Y的最高价氧化物对应的水化物发生反应 |
| B、Z、W形成的化合物中只有一种类型的化学键 |
| C、Y、Z的氢化物的稳定性Y<Z |
| D、X的原子半径一定小于Z |
下列叙述正确的是( )
| A、胶体都是胶状物质 | ||||
| B、溶液呈电中性,胶体带电荷 | ||||
| C、医疗上血液透析利用的是蛋白质、血细胞的微粒直径大于毒性物质的微粒直径的原理 | ||||
D、制备Fe(OH)3胶体的离子方程式为:Fe3++3H2O
|
1mol丙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气为( )
| A、5mol | B、6mol |
| C、7mol | D、8mol |
 2012年4月18日沈阳和平区查获“毒豆芽”,其中添加一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法中不正确的是( )
2012年4月18日沈阳和平区查获“毒豆芽”,其中添加一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星的说法中不正确的是( )| A、本品不溶于水,微溶于甲醇,可溶于酸和碱 |
| B、分子式为C19H22FN3O3 |
| C、该物质的一氯代物共有9种 |
| D、该物质能发生酯化、加成、氧化、硝化、缩聚反应 |
在周期表的前10号元素中,两种元素所在周期数之比等于它们所在的族序数之比,满足这种关系的元素共有( )
| A、1对 | B、2对 | C、3对 | D、4对 |
有关热化学方程式书写与对应表述均正确的是( )
| A、稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=+57.3 kJ?mol-1 |
| B、在101KPa下氢气的燃烧热△H=-285.5 kJ?mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ?mol-1 |
| C、已知2C(s)+O2(g)=2CO(g)△H=-221 kJ?mol-1,则可知C的燃烧热为110.5 kJ?mol-1 |
| D、密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)=FeS(s)△H=-95.6 kJ?mol-1 |
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.