题目内容
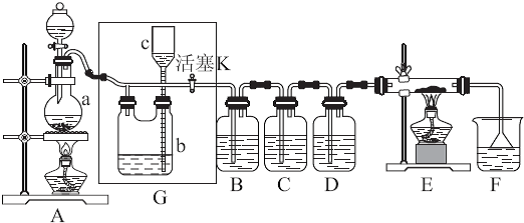
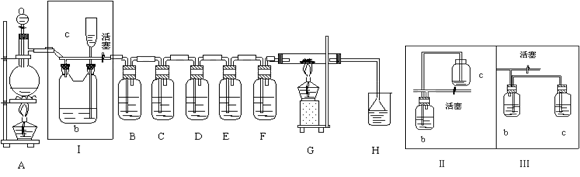
如图所示是一个制取Cl2并以Cl2 为原料进行特定反应的装置,其中各试剂瓶所装试剂为:B(Na2S)、C(FeBr2)、D(淀粉-KI)、E(SO2和BaCl2)、F(水)、H(紫色石蕊)

(1)写出实验室制取Cl2 的化学方程式
(2)Ⅰ中b 瓶内加入的液体是
(3)实验开始时,先点燃A 处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让Cl2 充满整个装置,再点燃G 处酒精灯,回答下列问题:
①下列装置中的现象是B
②写出E 中反应的离子方程式:
(4)G 中硬质玻璃管内盛有碳粉,反应后的产物为CO2 和HCl,写出G 中的反应的化学方程式
(5)在H 处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
分析:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应;
(2)氯化氢易挥发,收集需除去氯气中混有氯化氢气体,根据氯化氢和氯气的性质分析选用除杂试剂;
根据装置II和装置III的异同和气体的压强影响原理进行解答;
(3)①氯气具有强氧化性,能与S2-反应生成S浅黄色沉淀;
②氯气具有强氧化性,能与I-反应生成I2,碘单质与淀粉作用显蓝色;
(4)根据反应物和生成物书写化学方程式;
(5)紫色石蕊试液的颜色由紫色变为红色,为氯气和水反应生成了酸,后褪色是因为氯气和水反应生成的次氯酸具有漂白性.
(2)氯化氢易挥发,收集需除去氯气中混有氯化氢气体,根据氯化氢和氯气的性质分析选用除杂试剂;
根据装置II和装置III的异同和气体的压强影响原理进行解答;
(3)①氯气具有强氧化性,能与S2-反应生成S浅黄色沉淀;
②氯气具有强氧化性,能与I-反应生成I2,碘单质与淀粉作用显蓝色;
(4)根据反应物和生成物书写化学方程式;
(5)紫色石蕊试液的颜色由紫色变为红色,为氯气和水反应生成了酸,后褪色是因为氯气和水反应生成的次氯酸具有漂白性.
解答:解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)浓盐酸是易挥发性酸,制取的氯气中混有氯化氢气体,收集纯净的氯气需除去氯化氢,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以除去氯气中的氯化氢应选用饱和食盐水,所以Ⅰ中b 瓶内加入的液体是饱和食盐水,相当于排饱和食盐水收集氯气,氯气把饱和食盐水压倒上方开口的C瓶中;Ⅱ与Ⅲ的区别是III中C瓶是密封的气体无法将饱和食盐水压到C中,
故答案为:饱和食盐水;II;
(3)①氯气具有强氧化性,B中装有Na2S,氯气能将S2-氧化成生成S,反应为S2-+Cl2=S+2Cl-,单质硫为浅黄色;D中装有淀粉-KI,氯气能将I-氧化成I2,反应的离子方程式为2I-+Cl2=I2+2Cl-,碘单质与淀粉作用显蓝色,
故答案为:有浅黄色沉淀生成;溶液变蓝;
②E中有SO2和BaCl2,通入氯气,二氧化硫和氯气在水溶液中反应生成硫酸和盐酸,硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,反应的离子方程式为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,Ba2++SO42-=BaSO4↓,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,Ba2++SO42-=BaSO4↓;
(4)G中硬质玻璃管内盛有碳粉,通入氯气,所以反应物为碳、氯气、反应后的产物为CO2和HCl,所以反应物中还有水,反应方程式为C+2H2O+2Cl2═CO2↑+4HCl↑,
故答案为:C+2H2O+2Cl2═CO2↑+4HCl↑;
(5)氯气和水反应H2O+Cl2═HCl+HClO,生成的酸能使紫色的石蕊试液变红,因次氯酸具有漂白性,所以剩余的Cl2又与水作用生成HClO,又起漂白作用,使红色褪去,
故答案为:Cl2与H2O反应生成的酸,使紫色石蕊试液变红色,剩余的Cl2 又与水作用生成HClO,又起漂白作用,使红色褪去.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)浓盐酸是易挥发性酸,制取的氯气中混有氯化氢气体,收集纯净的氯气需除去氯化氢,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以除去氯气中的氯化氢应选用饱和食盐水,所以Ⅰ中b 瓶内加入的液体是饱和食盐水,相当于排饱和食盐水收集氯气,氯气把饱和食盐水压倒上方开口的C瓶中;Ⅱ与Ⅲ的区别是III中C瓶是密封的气体无法将饱和食盐水压到C中,
故答案为:饱和食盐水;II;
(3)①氯气具有强氧化性,B中装有Na2S,氯气能将S2-氧化成生成S,反应为S2-+Cl2=S+2Cl-,单质硫为浅黄色;D中装有淀粉-KI,氯气能将I-氧化成I2,反应的离子方程式为2I-+Cl2=I2+2Cl-,碘单质与淀粉作用显蓝色,
故答案为:有浅黄色沉淀生成;溶液变蓝;
②E中有SO2和BaCl2,通入氯气,二氧化硫和氯气在水溶液中反应生成硫酸和盐酸,硫酸和氯化钡反应生成硫酸钡沉淀和盐酸,反应的离子方程式为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,Ba2++SO42-=BaSO4↓,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,Ba2++SO42-=BaSO4↓;
(4)G中硬质玻璃管内盛有碳粉,通入氯气,所以反应物为碳、氯气、反应后的产物为CO2和HCl,所以反应物中还有水,反应方程式为C+2H2O+2Cl2═CO2↑+4HCl↑,
故答案为:C+2H2O+2Cl2═CO2↑+4HCl↑;
(5)氯气和水反应H2O+Cl2═HCl+HClO,生成的酸能使紫色的石蕊试液变红,因次氯酸具有漂白性,所以剩余的Cl2又与水作用生成HClO,又起漂白作用,使红色褪去,
故答案为:Cl2与H2O反应生成的酸,使紫色石蕊试液变红色,剩余的Cl2 又与水作用生成HClO,又起漂白作用,使红色褪去.
点评:本题考查较为综合,注意实验室制备氯气的实验原理,把握氯气的主要性质是解答该题的关键,题目难点在装置图的解读,题目难度中等.

练习册系列答案
相关题目