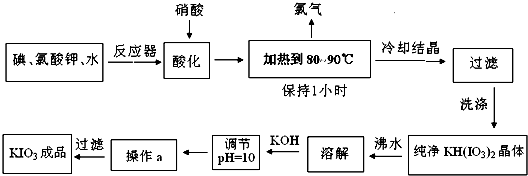
题目内容
碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:______.若有1mol I2完全反应,则该反应中转移电子的数目为______(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是______.
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为______.
(4)参照下表碘酸钾的溶解度,步骤 得到碘酸钾晶体,你建议的方法是______.
得到碘酸钾晶体,你建议的方法是______.
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
解:(1)I2是还原剂被氧化为KH(IO3)2,KClO3是氧化剂被还原为KCl、Cl2,生成两种还原产物所得电子数目相同,所以KCl、Cl2的系数之比为5:3,利用待定系数法,令KCl、Cl2的系数分别为5、3,氯原子获得电子总数为5×[5-(-1)]+3×2×5=60,根据电子转移守恒,所以I2的系数为 =6,再根据原子守恒配平,反应方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以一分子I2失去10个电子,所以转移电子数为I2的10倍,故1mol I2完全反应,则该反应中转移电子的数目为10NA,故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;10NA;
=6,再根据原子守恒配平,反应方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以一分子I2失去10个电子,所以转移电子数为I2的10倍,故1mol I2完全反应,则该反应中转移电子的数目为10NA,故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;10NA;
(2)步骤中产生氯气,需要将氯气排出反应体系,加入硝酸的目的是制造酸性环境,促进氯气从反应体系中逸出,
酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,能将已生成的碘酸氢钾还原,
故答案为:HI具有还原性,能将已生成的碘酸氢钾还原;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾,所以应将氯气排出,故答案为:Cl2能将KIO3氧化成KIO4;
(4)根据图表可知碘酸钾的溶解度随温度的变化不大,因此,需要用蒸发结晶的方法得到碘酸钾晶体,故答案为:蒸发结晶;
(5)电解碘化钾溶液,I-离子在阳极上被氧化为IO3-,H2O在阴极上放电被还原为H2.所以阳极电极反应式为I-+6OH--6e-=IO3-+2H2O,
故答案为:I-+6OH--6e-=IO3-+2H2O.
分析:(1)I2是还原剂被氧化为KH(IO3)2,KClO3是氧化剂被还原为KCl、Cl2,生成两种还原产物所得电子数目相同,所以KCl、Cl2的系数之比为5:3,利用待定系数法,令KCl、Cl2的系数分别为5、3,再根据电子转移守恒,原子守恒配平;
I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以一分子I2失去10个电子,所以转移电子数为I2的10倍;
(2)酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾;
(4)根据图表可知碘酸钾的溶解度随温度的变化不大来分析;
(5)电解碘化钾溶液,I-离子在阳极上被氧化为IO3-,H2O在阴极上放电被还原为H2.
点评:本题以工业生产碘酸钾为载体,内容涉及方程式配平、对工艺流程的理解评价、方案设计、电解原理等,难度中等,是对知识的综合运用和能力的考查.
 =6,再根据原子守恒配平,反应方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以一分子I2失去10个电子,所以转移电子数为I2的10倍,故1mol I2完全反应,则该反应中转移电子的数目为10NA,故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;10NA;
=6,再根据原子守恒配平,反应方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以一分子I2失去10个电子,所以转移电子数为I2的10倍,故1mol I2完全反应,则该反应中转移电子的数目为10NA,故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2;10NA;(2)步骤中产生氯气,需要将氯气排出反应体系,加入硝酸的目的是制造酸性环境,促进氯气从反应体系中逸出,
酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,能将已生成的碘酸氢钾还原,
故答案为:HI具有还原性,能将已生成的碘酸氢钾还原;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾,所以应将氯气排出,故答案为:Cl2能将KIO3氧化成KIO4;
(4)根据图表可知碘酸钾的溶解度随温度的变化不大,因此,需要用蒸发结晶的方法得到碘酸钾晶体,故答案为:蒸发结晶;
(5)电解碘化钾溶液,I-离子在阳极上被氧化为IO3-,H2O在阴极上放电被还原为H2.所以阳极电极反应式为I-+6OH--6e-=IO3-+2H2O,
故答案为:I-+6OH--6e-=IO3-+2H2O.
分析:(1)I2是还原剂被氧化为KH(IO3)2,KClO3是氧化剂被还原为KCl、Cl2,生成两种还原产物所得电子数目相同,所以KCl、Cl2的系数之比为5:3,利用待定系数法,令KCl、Cl2的系数分别为5、3,再根据电子转移守恒,原子守恒配平;
I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以一分子I2失去10个电子,所以转移电子数为I2的10倍;
(2)酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾;
(4)根据图表可知碘酸钾的溶解度随温度的变化不大来分析;
(5)电解碘化钾溶液,I-离子在阳极上被氧化为IO3-,H2O在阴极上放电被还原为H2.
点评:本题以工业生产碘酸钾为载体,内容涉及方程式配平、对工艺流程的理解评价、方案设计、电解原理等,难度中等,是对知识的综合运用和能力的考查.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
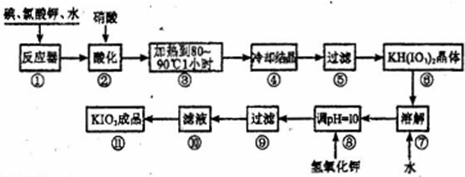

 得到碘酸钾晶体,你建议的方法是
得到碘酸钾晶体,你建议的方法是