题目内容
【题目】电化学在日常生活中用途广泛,如图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓。如图②是电解法除去工业废水中的Cr2O72-,下列说法正确的是( )
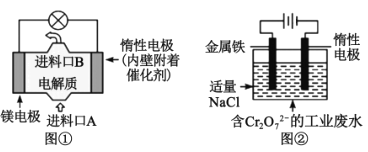
A.图①中镁电极发生的反应是:ClO-+H2O+2e-=Cl-+2OH-
B.图②最终得到Fe(OH)3和Cr(OH)3,则阳极上的电极反应式为:Fe-3e-=Fe3+
C.图②中每转移0.2mol电子,阴极逸出2.24LH2
D.若图①中7.2gMg溶解产生的电量用于图②废水处理,理论得到Fe(OH)3的物质的量为0.3mol
【答案】D
【解析】
A.图①为原电池,镁做负极,则镁电极发生的反应是:Mg-2e-=Mg2+,ClO-+H2O+2e-=Cl-+2OH-为惰性电极即正极的电极反应,故A错误;
B.图②为电解池,铁做阳极,惰性电极作阴极,最终得到Fe(OH)3和Cr(OH)3,则阳极上的电极反应式为:Fe-2e-=Fe2+,故B错误;
C.图②为电解池,阴极为氢离子放电,电解水,则阴极的电极反应为:2H++2e-=H2↑,每转移0.2mol电子,生成0.1mol氢气,标况下的体积为2.24L,题中未给出生成气体的状态,故C错误;
D.若图①中7.2gMg溶解,物质的量为0.3mol,根据电子得失守恒,6Mg~6Fe2+~Cr2O72-~ 6Fe(OH)3,则产生的电量用于图②废水处理,理论得到Fe(OH)3的物质的量为0.3mol,故D正确;
答案选D。

【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如图该条件下,1molN2和1molO2完全反应生成NO会吸收______kJ能量。

(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请表中数据补充完整:a___________;b___________。
②能验证温度对化学反应速率规律的是实验________![]() 填实验序号
填实验序号![]() 。
。
(3)在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) |
|
|
|
|
|
|
①用![]() 表示从0-2s内该反应的平均速率
表示从0-2s内该反应的平均速率![]() ______。
______。
②能说明该反应已达到平衡状态的是______
a.单位时间内消耗nmol![]() 的同时,生成2nmol
的同时,生成2nmol![]()
b.容器内各物质的浓度保持不变
c. 2v逆(NO)=v正(O2)
d.混合气体的总物质的量不随时间的变化而变化
【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。