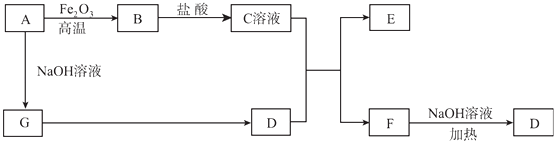
ЬтФПФкШн
ЁОЬтФПЁПвбжЊПЩФцЗДгІЃКMЃЈgЃЉ+NЃЈgЃЉPЃЈgЃЉ+QЃЈgЃЉ HЃО0ЃЌЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉдкФГЮТЖШЯТЃЌЗДгІЮяЦ№ЪМХЈЖШЗжБ№ЮЊЃКcЃЈMЃЉ=1molLЉ1 ЃЌ cЃЈNЃЉ=2.4molLЉ1 ЃЌ ДяЕНЦНКтКѓЃЌMЕФзЊЛЏТЪЮЊ60%ЃЌДЫЪБNЕФзЊЛЏТЪЮЊ
ЃЈ2ЃЉШєЗДгІЮТЖШЩ§ИпЃЌзЊЛЏТЪЃЈЬюЁАдіДѓЁБЁЂЁАМѕЩйЁБЛђЁАВЛБфЁБЃЉЃЎ
ЃЈ3ЃЉШєЗДгІЮТЖШВЛБфЃЌЗДгІЮяЕФЦ№ЪМХЈЖШЗжБ№ЮЊЃКcЃЈMЃЉ=4molLЉ1 ЃЌ cЃЈNЃЉ=a molLЉ1ЃЛДяЕНЦНКтКѓЃЌcЃЈPЃЉ=2molLЉ1 ЃЌ a= ЃЎ
ЃЈ4ЃЉШєЗДгІЮТЖШВЛБфЃЌЗДгІЮяЕФЦ№ЪМХЈЖШЗжБ№ЮЊЃКcЃЈMЃЉ=1molLЉ1 ЃЌ cЃЈNЃЉ=0.3molLЉ1ЃЛДяЕНЦНКтКѓЃЌMЕФзЊЛЏТЪЮЊ ЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉ25%
ЃЈ2ЃЉдіДѓ
ЃЈ3ЃЉ6
ЃЈ4ЃЉ20%
ЁОНтЮіЁПНтЃКЃЈ1ЃЉЁїcЃЈMЃЉ=60%ЁС1molLЉ1=0.6molLЉ1 ЃЌ ХЈЖШБфЛЏСПжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌЫљвдЁїcЃЈNЃЉ=ЁїcЃЈMЃЉ=0.6molLЉ1 ЃЌ ЙЪДЫЪБNЕФзЊЛЏТЪ ![]() ЁС100%=25%ЃЌЫљвдД№АИЪЧЃК25%ЃЛЃЈ2ЃЉИУЗДгІе§ЗДгІЮЊЮќШШЗДгІЃЌЩ§ИпЮТЖШЦНКтЯђЮќШШЗНЯђвЦЖЏЃЌМДЯђе§ЗДгІЗНЯђвЦЖЏЃЌMЕФзЊЛЏТЪдіДѓЃЌ
ЁС100%=25%ЃЌЫљвдД№АИЪЧЃК25%ЃЛЃЈ2ЃЉИУЗДгІе§ЗДгІЮЊЮќШШЗДгІЃЌЩ§ИпЮТЖШЦНКтЯђЮќШШЗНЯђвЦЖЏЃЌМДЯђе§ЗДгІЗНЯђвЦЖЏЃЌMЕФзЊЛЏТЪдіДѓЃЌ
ЫљвдД№АИЪЧЃКдіДѓЃЛЃЈ3ЃЉ
ЁїcЃЈMЃЉ=60%ЁС1molLЉ1=0.6molLЉ1 ЃЌ дђЃК
MЃЈgЃЉ+ | NЃЈgЃЉ | PЃЈgЃЉ+ | QЃЈgЃЉ | ||
ГѕЪМЃЈmol/LЃЉЃК | 1 | 2.4 | 0 | 0 | |
зЊЛЏЃЈmol/LЃЉЃК | 0.6 | 0.6 | 0.6 | 0.6 | |
ЦНКтЃЈmol/LЃЉЃК | 0.4 | 1.8 | 0.6 | 0.6 |
ЙЪИУЮТЖШЯТЦНКтГЃЪ§k= ![]() =0.5ЃЌ
=0.5ЃЌ
ЗДгІЮТЖШВЛБфЃЌЗДгІЮяЕФЦ№ЪМХЈЖШЗжБ№ЮЊcЃЈMЃЉ=4molLЉ1 ЃЌ cЃЈNЃЉ=amolLЉ1ЃЛДяЕНЦНКтКѓЃЌcЃЈPЃЉ=2molLЉ1 ЃЌ дђЃК
MЃЈgЃЉ+ | NЃЈgЃЉ | PЃЈgЃЉ+ | QЃЈgЃЉ | ||
ГѕЪМЃЈmol/LЃЉЃК | 4 | a | 0 | 0 | |
зЊЛЏЃЈmol/LЃЉЃК | 2 | 2 | 2 | 2 | |
ЦНКтЃЈmol/LЃЉЃК | 2 | a-2 | 2 | 2 |
Ыљвд ![]() =0.5ЃЌНтЕУa=6ЃЌ
=0.5ЃЌНтЕУa=6ЃЌ
ЫљвдД№АИЪЧЃК6ЃЛЃЈ4ЃЉЩшMЕФзЊЛЏТЪЮЊxЃЌвРОнЛЏбЇШ§ЖЮЪНСаЪНМЦЫу
MЃЈgЃЉ+ | NЃЈgЃЉ | PЃЈgЃЉ+ | QЃЈgЃЉ | ||
ГѕЪМЃЈmol/LЃЉЃК | 1 | 0.3 | 0 | 0 | |
зЊЛЏЃЈmol/LЃЉЃК | x | x | x | x | |
ЦНКтЃЈmol/LЃЉЃК | 1Љx | 0.3Љx | x | x |
дђДяЕНЦНКтКѓИїЮяжЪЕФЦНКтХЈЖШЗжБ№ЮЊЃК
cЃЈMЃЉ=ЃЈ1ЉxЃЉmol/L ЁЁcЃЈNЃЉ=ЃЈ0.3ЉxЃЉmol/L
cЃЈPЃЉ=x mol/LЁЁcЃЈQЃЉ=x mol/L
K= ![]()
= ![]() =0.5ЃЛ
=0.5ЃЛ
x=0.20ЃЛ
ЫљвдД№АИЪЧЃК20%ЃЎ
ЁОПМЕуОЋЮіЁПНтД№ДЫЬтЕФЙиМќдкгкРэНтЛЏбЇЦНКтзДЬЌБОжЪМАЬиеїЕФЯрЙижЊЪЖЃЌеЦЮеЛЏбЇЦНКтзДЬЌЕФЬиеїЃКЁАЕШЁБМД Vе§=VФц>0ЃЛЁАЖЏЁБМДЪЧЖЏЬЌЦНКтЃЌЦНКтЪБЗДгІШддкНјааЃЛЁАЖЈЁБМДЗДгІЛьКЯЮяжаИїзщЗжАйЗжКЌСПВЛБфЃЛЁАБфЁБМДЬѕМўИФБфЃЌЦНКтБЛДђЦЦЃЌВЂдкаТЕФЬѕМўЯТНЈСЂаТЕФЛЏбЇЦНКтЃЛгыЭООЖЮоЙиЃЌЭтНчЬѕМўВЛБфЃЌПЩФцЗДгІЮоТлЪЧДге§ЗДгІПЊЪМЃЌЛЙЪЧДгФцЗДгІПЊЪМЃЌЖМПЩНЈСЂЭЌвЛЦНКтзДЬЌЃЈЕШаЇЃЉЃЌвдМАЖдЛЏбЇЦНКтЕФМЦЫуЕФРэНтЃЌСЫНтЗДгІЮязЊЛЏТЪ=зЊЛЏХЈЖШЁТЦ№ЪМХЈЖШЁС100%=зЊЛЏЮяжЪЕФСПЁТЦ№ЪМЮяжЪЕФСПЁС100%ЃЛВњЦЗЕФВњТЪ=ЪЕМЪЩњГЩВњЮяЕФЮяжЪЕФСПЁТРэТлЩЯПЩЕУЕНВњЮяЕФЮяжЪЕФСПЁС100%ЃЎ

 аТЫМЮЌКЎМйзївЕЯЕСаД№АИ
аТЫМЮЌКЎМйзївЕЯЕСаД№АИ