题目内容
18.下列操作不正确的是( )| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 含不溶性杂质的粗苯甲酸进行重结晶分离的操作步骤之一是趁热过滤 | |
| C. | 做银镜反应实验后,用硝酸洗涤试管壁上的银镜 | |
| D. | 制备乙酸乙酯时,先向大试管中加入浓硫酸,再逐滴加入乙醇和乙酸 |
分析 A.水与电石反应较快,饱和食盐水可减缓反应速率;
B.温度低时苯甲酸的溶解度小;
C.Ag与硝酸反应;
D.应先加乙醇、再加浓硫酸,最后加乙酸.
解答 解:A.水与电石反应较快,饱和食盐水可减缓反应速率,则有效控制产生乙炔的速率,故A正确;
B.温度低时苯甲酸的溶解度小,则重结晶分离的操作步骤之一是趁热过滤,防止苯甲酸损失,故B正确;
C.Ag与硝酸反应,则用硝酸洗涤试管壁上的银镜,故C正确;
D.应先加乙醇、再加浓硫酸,最后加乙酸,可防止液滴飞溅,充分利用原料,试剂顺序不合理,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、常见气体制备原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
9.下列化学反应在冶金工业中没有得到广泛应用的是( )
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | B. | Al2O3+3C$\frac{\underline{\;高温\;}}{\;}$2Al+3CO↑ | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
6.下列比较错误的是( )
| A. | 稳定性:CH4>SiH4 | B. | 碱性:Mg(OH )2>Ca(OH )2 | ||
| C. | 羟基中H的活泼性:H2O>CH3CH2OH | D. | 原子半径:S>Cl |
13.下列说法中正确的是( )
| A. | 每一周期的元素都是从碱金属开始,最后以稀有气体结束 | |
| B. | 同一周期中(除第一周期外),从左到右,各元素原子核的电子数都是从1个逐渐增加到8个 | |
| C. | 元素周期表一共有7个周期,16个族 | |
| D. | 第七周期只有23种元素 |
3.一定条件下(恒温、恒容的密闭容器中)合成氨反应处于化学平衡状态的是( )
| A. | υ(N2生成)=3υ(H2消耗) | |
| B. | H2、H2、HN3的分子数之比为1:3:2 | |
| C. | 单位时间内生成2molNH3,同时消耗1molH2 | |
| D. | 容器内的压强不再变化 |
10.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
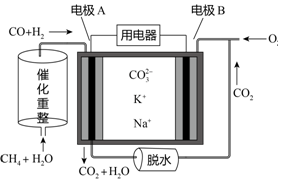

| A. | 电极A上H2和CO都发生了氧化反应 | |
| B. | 反应CH4+H2O$\frac{\underline{\;催化剂\;}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| C. | 电池工作时,电能转变为化学能 | |
| D. | 电极B上发生的电极反应为:O2+2H2O+4e-═4OH- |
8.下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
| D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |

 ;在④⑤⑦三种元素中,简单离子半径最大的是S2-(用离子符号表示).
;在④⑤⑦三种元素中,简单离子半径最大的是S2-(用离子符号表示). .
. .
.