题目内容
4.近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
请完成并配平上述化学方程式.其中氧化剂是K2Cr2O7,氧化产物是CO2.
分析 反应中C元素化合价由0价升高到+4价,Cr元素从+6价降低到+3价,依据氧化还原反应得失电子守恒规律结合原子个数守恒规律书写方程式,氧化还原反应中所含元素化合价降低的反应物为氧化剂,对应还原产物,所含元素化合价升高的为还原剂,对应氧化产物.
解答 解:反应中C元素化合价由0价升高到+4价,Cr元素从+6价降低到+3价,所以K2Cr2O7作氧化剂,对应产物Cr2(SO4)3为还原产物,C做还原剂,对应产物CO2为氧化产物,要使氧化剂得到电子总数等于还原剂失去电子总数,则C系数为3,K2Cr2O7系数为2,依据原子个数守恒,反应方程式为:
3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O;
故答案为:3;2; 8; 3; 2;2;8; K2Cr2O7;CO2;
点评 本题考查了氧化还原反应方程式配平及相关概念,明确氧化还原反应中各元素化合价变化及氧化还原反应得失电子守恒规律是解题关键,题目难度不大.

练习册系列答案
相关题目
15.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl
此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
(1)此反应在110℃时平衡常数为1.
(2)实验l中,CCl4的转化率A大于50%(填“大于”、“小于”或“等于”).
(3)实验3中,B的值D(选填序号).
A.等于50% B.大于50% C.小于50%D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol•L-1和4mol•L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).在图中的四条线中,表示H2起始浓度为2mol•L-1实验的消耗CCl4的百分率变化曲线是c(选填序号).
此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应).
| 实验 序号 | 温度℃ | 初始CCl4浓度 (mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的平衡转化率 |
| 1 | 110 | 1 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 100 | 1 | 1 | B |
(2)实验l中,CCl4的转化率A大于50%(填“大于”、“小于”或“等于”).
(3)实验3中,B的值D(选填序号).
A.等于50% B.大于50% C.小于50%D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2mol•L-1和4mol•L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线).在图中的四条线中,表示H2起始浓度为2mol•L-1实验的消耗CCl4的百分率变化曲线是c(选填序号).

9.将3g 的CO与H2的混合气体和足量的氧气充分反应后,在150℃时将混合气体通过足量的Na2O2固体,则Na2O2固体增加的质量为( )
| A. | 1.5g | B. | 3g | C. | 6g | D. | 无法确定 |
16.在蒸发皿中加热蒸干下列物质的水溶液并灼烧固体,可以得到该溶质固体的是( )
| A. | 氯化铜 | B. | 碳酸氢钙 | C. | 高锰酸钾 | D. | 偏铝酸钠 |
13.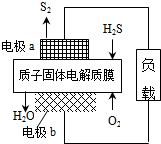 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为:O2+2H2O+4e-=4 OH- | |
| C. | 电路中每流过4mol电子,电池内部释放632kJ热能 | |
| D. | 每17gH2S参与反应,有1mol H+经质子膜进入正极区 |
14.短周期主族元素X、Y、Z、W原子序数依次增大,X与Z原子序数相差8,Y元素的焰色为黄色,Z元素的最高价为+6.下列叙述正确的是( )
| A. | X2-的离子半径大于Y+的离子半径 | |
| B. | H2Z的沸点高于H2X | |
| C. | Z的简单气态氢化物稳定性比W的强 | |
| D. | Y2X2和Y2Z的晶体类型和化学键类型完全相同 |

 碳酸钠一过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠一过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: