题目内容
2.只用一种试剂可区别硫酸钠,硫酸镁,氯化铝,氯化铵四种溶液,这种试剂是( )| A. | 盐酸 | B. | 氢氧化钠 | C. | 氯化钡 | D. | 硝酸银 |
分析 四种物质含有的阳离子各不相同,可加入碱溶液检验,生成不同的物质,如现象不同,可鉴别,以此解答该题.
解答 解:A.加入盐酸,都不反应,不能鉴别,故A错误;
B.加入氢氧化钠溶液,现象分别为无现象、白色沉淀、先生成白色沉淀,后溶解、生成刺激性气味的气体,可鉴别,故B正确;
C.加入氯化钡,硫酸钠,硫酸镁都生成沉淀,不能鉴别,氯化铝,氯化铵都不反应,也不能鉴别,故C错误;
D.加入硝酸银溶液,都生成沉淀,不能鉴别,故D错误.
故选B.
点评 本题考查物质的鉴别,为高频考点,本题注意常见物质的化学性质和反应现象,注重相关基础知识的积累,此类题目不难解答,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 气体的摩尔体积是22.4L | |
| B. | 1L 1mol/L MgCl2溶液中Cl-的物质的量浓度为1mol/L | |
| C. | 1mol NaOH的质量为40g | |
| D. | 1mol氧和1mol水所含的分子数相等 |
17.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
| B | C |
| D |
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | A、B、C三种元素形成的化合物,晶体类型一定相同 | |
| D. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 |
7.下列有关物质性质的应用正确的是( )
| A. | 生石灰能与水反应,可用来干燥氯气 | |
| B. | 氯化铝是一种电解质,可用于电解法制铝 | |
| C. | 液氨汽化时要吸收大量的热,可用做制冷剂 | |
| D. | 二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
14.如图是产生和收集气体的实验装置,该装置最适合( )
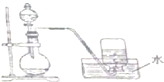

| A. | 氯酸钾和二氧化锰的混合物制取氧气 | |
| B. | 石灰石和盐酸制取二氧化碳 | |
| C. | 浓盐酸和二氧化锰制取氯气 | |
| D. | 铜与稀硝酸反应制取一氧化氮 |
11.下列离子方程式的书写正确的是( )
| A. | 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42-=BaSO4↓ | |
| B. | 钠与水的反应Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
12.有BaCl2和NaCl的混合溶液aL,将它均分成两份.一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀.反应中消耗xmol H2SO4、ymol AgNO3.据此得知原混合溶液中的c(Na+)为( )
| A. | $\frac{y-2x}{a}$ mol/L | B. | $\frac{y-x}{a}$ mol/L | C. | $\frac{2y-2x}{a}$ mol/L | D. | $\frac{2y-4x}{a}$mol/L |
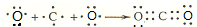 .
.
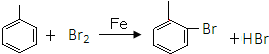 .
. .
.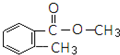 .
. 或
或  的邻、间、对的任意一种.
的邻、间、对的任意一种.