��Ŀ����
����Ŀ���������������������������Ҫԭ��֮һ���������������ж��ַ�����
��1�������ü������ԭ���������֪��
CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g) ��H����574kJ/mol
CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g) ��H����1160kJ/mol
��CH4(g)��NO2(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ�� ��
��2��NH3����ԭ����������SCR)������ĿǰӦ����㷺���������������ѳ������������Ļ�ѧ��Ӧ�ǣ�2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g)��H<0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ�ǣ�һ�����ɣ� ��
2N2(g)��3H2O(g)��H<0��Ϊ��ߵ��������ת���ʿɲ�ȡ�Ĵ�ʩ�ǣ�һ�����ɣ� ��
��3������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0
2CO2(g)+N2(g)����H��0
�ٸ÷�Ӧƽ�ⳣ������ʽ
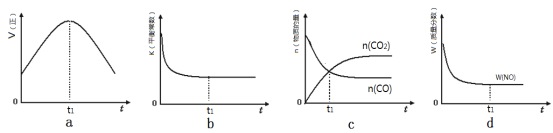
�����÷�Ӧ���������������ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ���
��4������ClO2�����������ﷴӦ�������£�![]()
��Ӧ��Ļ�ѧ����ʽ��2NO+ClO2+H2O===NO2+HNO3+2HCl����Ӧ��Ļ�ѧ����ʽ�ǡ�����11.2LN2���ɣ���״������������ClO2 g��
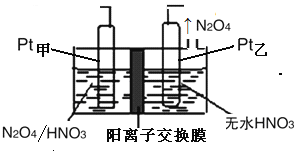
��5����ҵ�����к��е�NO2�����õ�ⷨ��������NO2Ϊԭ�Ͽ���������ɫ������N2O5���Ʊ�����֮һ���Ƚ�NO2ת��ΪN2O4Ȼ����õ�ⷨ�Ʊ�N2O5��װ������ͼ��ʾ��Pt��Ϊ�ĵ缫��Ӧʽ�� ��
���𰸡���1��CH4(g)��2NO2(g)��N2(g)��CO2(g)��2H2O(g)��H����867kJ/mol
��2������NH3Ũ�ȣ���ѹǿ�������¶ȣ�
��3����![]() ��bd
��bd
��4��2NO2+4Na2SO3��N2+4Na2SO4��67.5
��5��N2O4+2HNO3��2e����2N2O5+2H+
��������
�����������1����֪����CH4(g)��4NO2(g)��4NO(g)��CO2(g)��2H2O(g)��H����574kJ/mol
��CH4(g)��4NO(g)��2N2(g)��CO2(g)��2H2O(g)��H����1160kJ/mol
����ݸ�˹���ɿ�֪����+�ڣ�/2���õ�CH4(g)��NO2(g)��ԭΪN2(g)���Ȼ�ѧ����ʽ��CH4(g)��2NO2(g)��N2(g)��CO2(g)��2H2O(g)��H����867kJ/mol��
��2����ѧ��Ӧ��2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O���������������ķ��ȷ�Ӧ�����NOx��ת������ƽ�������ƶ�������Բ�ȡ�Ĵ�ʩ������NH3Ũ������ѹǿ�������¶�����
2N2(g)+3H2O���������������ķ��ȷ�Ӧ�����NOx��ת������ƽ�������ƶ�������Բ�ȡ�Ĵ�ʩ������NH3Ũ������ѹǿ�������¶�����
��3���ٻ�ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����ݷ���ʽ��֪�÷�Ӧƽ�ⳣ������ʽ![]() ��
��
��a��t1ʱ����Ӧ������Ȼ�ڱ仯��˵��û�дﵽƽ��״̬��a����B��t1ʱƽ�ⳣ�����ٱ仯�����淴Ӧ������ȣ�˵���ﵽ��ƽ��״̬��b��ȷ��C��t1ʱ������̼��һ�����������ʵ������ڱ仯��˵�����淴Ӧ���ʲ���ȣ���Ӧû�дﵽƽ��״̬��c����D��t1ʱһ�������������������ٱ仯���������淴Ӧ������ȣ��ﵽ��ƽ��״̬��d��ȷ����ѡbd��
��3����Ӧ�����������Ʊ�����Ϊ�����ƣ�ͬʱ������������Ӧ�Ļ�ѧ����ʽ��2NO2+4Na2SO3��N2+4Na2SO4�����ݷ�Ӧ�ķ���ʽ��֪ת����ϵʽ�У�2ClO2��2NO2��N2��n(ClO2)=2n(NO2)=1mol��m(ClO2)=67.5g��
��5��Pt�缫�Ҳ���N2O4��˵����������õ����ӣ���������������Pt�缫����������N2O4ʧȥ����ת��ΪN2O5���缫��ӦʽΪN2O4+2HNO3��2e����2N2O5+2H+��