题目内容
在恒温恒容条件下(500℃),发生H2S+O2→SO2+H2O,反应后容器内一定增大的数值是( )
| A.气体的质量 | B.气体的密度 |
| C.压强 | D.气体平均相对分子质量 |
500℃下,发生反应:2H2S+3O2=2SO2+2H2O,各种物质均是气体.
A、根据质量守恒思想,该反应后气体质量不变,故A错误;
B、根据密度ρ=
,在恒容下,质量不变,所以密度不变,故B错误;
C、反应以后气体的物质的量是减小的,所以气体的压强是变小的,故C错误;
D、气体的平均相对分子质量M=
,反应后气体的质量不变,物质的量减小,所以气体的平均相对分子质量会增大,故D正确.
故选D.
A、根据质量守恒思想,该反应后气体质量不变,故A错误;
B、根据密度ρ=
| m |
| V |
C、反应以后气体的物质的量是减小的,所以气体的压强是变小的,故C错误;
D、气体的平均相对分子质量M=
| m |
| n |
故选D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
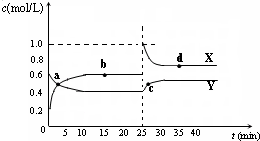
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g)?4NO2(g)+O2(g),△H>0.起始N2O5(g)的浓度为5mol/L,其他物质的浓度为零.T1温度下的部分实验数据见表.
实验数据:
下列说法中,正确的是( )
实验数据:
| t/s | 0 | 100 | 300 | 500 |
| c(NO2)/mol/L | 0 | 2.96 | 5.00 | 5.00 |
| A、在恒温恒容条件下,单位时间内生成2n mol N2O5(g),同时消耗4n mol NO2(g),说明该反应达到了平衡状态 |
| B、T1温度下的平衡常数为K1,若维持T1温度不变,增加体系压强,平衡向逆向移动,达到新平衡时,平衡常数为K2,则K1>K2 |
| C、T1温度下的平衡常数为K1=125,500s时反应物转化率为50% |
| D、其他条件不变时,T2温度下反应达到平衡时测得N2O5(g)浓度为2.98mol/L,则T1<T2 |
 容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示. HCO3-+OH-
HCO3-+OH-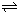 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.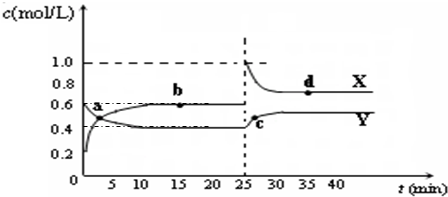
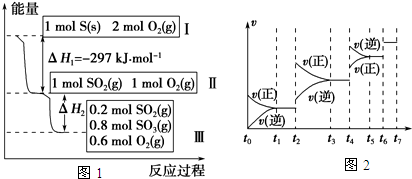
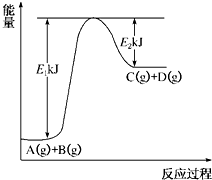 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题: