题目内容
25 ℃时,若体积Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb,a=0.5b,a的取值范围是A.7/2<a<14/3 B.7<a<14
C.3<a<5 D.9/2<a<15/2
A 一方面,从酸碱中和的角度考虑,Va×10-a=Vb×10-(14-b) Va<Vb
由10-a>10-(14-b) a<14-b再利用a=0.5b可得a<14/3;另一方面,a<7,b>7,a=0.5b,所以a>7/2。故7/2<a<14/3。

 世纪百通期末金卷系列答案
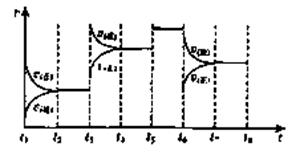
世纪百通期末金卷系列答案(10分)25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
|
|
|
|
|
|
|
|
|
|
K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)A的转化率最大的一段时间是
(10分)25°C时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(m ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
ol)随时间t的变化如右图所示,已知达平衡后,降低温度,A的转化率将增大。
(1)根据上图数据,写出该反应的化学方程式: ;此反应的平衡常数表达式K= ,从反应开始到达第一次平衡时的平均速率v(A)为 。
(2)在5—7min内,若K值不变,则此处曲线变化的原因是
(3)下图表示此反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
 |  |  |  |
 |  |  |  |