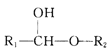
题目内容
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为 ,E元素在周期表中的位置为 ,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式 。
(2)经测定A2W2为二元弱酸,A2W2的电子式为 ,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是 。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式 ,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
【答案】(1) ,第三周期第ⅢA族;Al2O3+2OH﹣=2AlO2﹣+H2O;
,第三周期第ⅢA族;Al2O3+2OH﹣=2AlO2﹣+H2O;
(2)![]() (2分)BaO2+H2SO4=BaSO4↓+H2O2;(2分)
(2分)BaO2+H2SO4=BaSO4↓+H2O2;(2分)
(3)2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2;(2分)
(4)NaH+H2O=NaOH+H2↑,(2分)56.(2分)
【解析】试题分析:A、B、W、D、E为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素;A、D同主族,则D为Na元素;E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期ⅢA族元素,故E为Al元素;A、B、W、D、E五元素质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素;
(1)O2-的离子结构示意图为![]() ;E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-="2" AlO2-+H2O;
;E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期第ⅢA族,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-="2" AlO2-+H2O;
(2)A2W2为H2O2,是二元弱酸,其电子式为![]() ,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2;
,硫酸处理BaO2来制备H2O2,则还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2;
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入H2O2,观察到溶液呈蓝色并有红褐色沉淀生成,反应生成Fe(OH)3与I2,当消耗2mol I-时,共转移3mol电子,说明被氧化的Fe2+为1mol,参加反应的H2O2为1.5mol,该反应的离子方程式是:2Fe2++4I-+3H2O2=2Fe(OH)3↓+2I2;
(4)NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】现有反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
CO2(g)+H2(g) ΔH<0,在850℃时,K=1。
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填“正反应”或“逆反应”)方向移动。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(2) 已知在一定温度下:
C(s)+CO2(g)![]() 2CO(g)平衡常数K1;
2CO(g)平衡常数K1;
C(s)+H2O(g)![]() CO(g)+H2(g)平衡常数K2;
CO(g)+H2(g)平衡常数K2;
CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K;
H2(g)+CO2(g)平衡常数K;
则K1、K2 、K之间的关系是___________。
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+216 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2
已知CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-44 kJ·mol-1,则ΔH2=_________。
(4)某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
①写出大试管中发生反应的化学方程式: ,该反应是 反应(填放热或吸热)。
②实验结果表明,催化剂的催化效果与 有关。