��Ŀ����
��2L�ĺ���������,����1molA��3molB������һ�������·������·�Ӧ��
A��s��+3B��g�� 2C��g��
2C��g��
����3s����C��Ũ��Ϊ0.6mol•L��1������ѡ��˵����ȷ�������
����A��ʾ�ķ�Ӧ����Ϊ0.1mol•L��1•s��1
����B��ʾ�ķ�Ӧ����Ϊ0.4mol•L��1•s��1
��3sʱ����C�����ʵ���Ϊ1.2 mol
��3sʱB��Ũ��Ϊ0.6mol•L��1
A���٢ڢ� B���٢ۢ� C���ۢ� D���ڢۢ�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�������̼�Ļ��������ǻ��������о��ȵ㡣
��1����̫���ܵ������£���CO2Ϊԭ����ȡ̿�ڵ���������ͼ��ʾ���ܷ�Ӧ�Ļ�ѧ����ʽΪ ��

��2����һ����CO2�����״�ȼ�ϵķ�����CO2��3H2 CH3OH��H2O����֪298K��101KPa�����£�
CH3OH��H2O����֪298K��101KPa�����£�
CO2(g)��3H2(g) CH3OH(g)��H2O(l) ��H����a kJ��mol��1��
CH3OH(g)��H2O(l) ��H����a kJ��mol��1��
2H2(g)��O2(g)��2H2O(l) ��H����b kJ��mol��1��
CH3OH(g)��CH3OH(l) ��H����c kJ��mol��1��
��CH3OH(l)�ı�ȼ���ȡ�H��___________________��
��3��CO2�������⻯�ϳɵ�̼ϩ�����ϳ���ϩ��ӦΪ
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) ��H<0
CH2= CH2(g) +4H2O(g) ��H<0
�ں����ܱ������г���2 mol CO2��n mol H2����һ�������·�����Ӧ��CO2��ת�������¶ȡ�Ͷ�ϱ� �Ĺ�ϵ����ͼ��ʾ��
�Ĺ�ϵ����ͼ��ʾ��
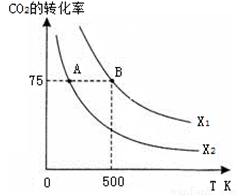
��ƽ�ⳣ��KA KB
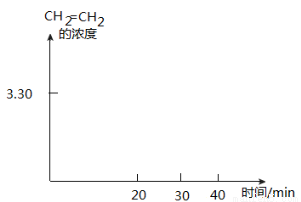
��T Kʱ��ij�ܱ���������������Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ��(min) Ũ��(mol��L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min��ֻ�ı���ijһ�����������ϱ��е������жϸı������������
A��ͨ��һ����H2 B��ͨ��һ����CH2=CH2
C��������ʴ��� D����С�������
����CH2=CH2��Ũ���淴Ӧʱ��ı仯���ߡ�
��4���ڴ���M�������£�CO2��H2ͬʱ��������������Ӧ
A��2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) ��H< 0
CH2= CH2(g) +4H2O(g) ��H< 0
B��2CO2(g) + 6H2(g)  CH3OCH3(g)+3H2O(g) ��H< 0
CH3OCH3(g)+3H2O(g) ��H< 0

��ͼ����ϩ����ͬʱ���ڣ���ͬ�¶��µIJ��ʣ������460��ʱ��ϩ���ʽ��͵�ԭ������
A������M�Ļ��Խ��� B��A��Ӧ��ƽ�ⳣ�����
C�����ɼ��ѵ������� D��B��Ӧ�Ļ������
��5��Na2CO3��ҺҲͨ����������CO2�������£�H2CO3�ĵ�һ�����ڶ������볣���ֱ�ԼΪKa1=4��10-7 ��Ka2=5��10-11����0.5mol��L��1��Na2CO3��Һ��pH���� �������ǵڶ���ˮ���H2O�ĵ��룩
���³�ѹ�¶���1 mol(����)������ӻ�ѧ�������յ��������γ�1 mol(����)������ӻ�ѧ�����ų���������Ϊ����(��λΪkJ��mol��1)���±���һЩ��������(kJ��mol��1)��
��ѧ�� | ���� | ��ѧ�� | ���� | ��ѧ�� | ���� |
C��F | 427 | C��Cl | 330 | C��I | 218 |
H��H | 436 | S��S | 255 | H��S | 339 |
������������⡣
��1���ɱ������ݹ���Ԥ��C��Br���ļ��ܷ�Χ��_ <C��Br����< (��д��ֵ�͵�λ)
��2���Ȼ�ѧ����ʽ2H2(g)��S2(g)=2H2S(g) ��H�� Q kJ��mol��1����Q�� __
��3�� ��֪�����Ȼ�ѧ����ʽ��
O2 (g) = O (g)��e�� ��H1�� ��1175.7 kJ��mol��1
(g)��e�� ��H1�� ��1175.7 kJ��mol��1
PtF6(g)��e��= PtF (g) ��H2�� ��771.1 kJ��mol��1
(g) ��H2�� ��771.1 kJ��mol��1
O PtF
PtF (s) = O
(s) = O (g)��PtF
(g)��PtF (g) ��H3�� ��482.2 kJ��mol��1
(g) ��H3�� ��482.2 kJ��mol��1
��ӦO2(g) ��___ ___(g)��O PtF
PtF (s) ��H��___ ___kJ��mol��1��
(s) ��H��___ ___kJ��mol��1��


 ����������ᴿ�ķ����㷺����ʵ���о���������
����������ᴿ�ķ����㷺����ʵ���о���������

 2H+��Cl����ClO��
2H+��Cl����ClO�� xC(g)��3mol A��2mol B����һ�������·�Ӧ���ﵽƽ��ʱC���������Ϊa;����A��B��C��ʼͶ������ʵ����ֱ�Ϊn(A)��n(B)��n(C)������ͬ�����´ﵽƽ��ʱ��C���������ҲΪA�������й�������ȷ����
xC(g)��3mol A��2mol B����һ�������·�Ӧ���ﵽƽ��ʱC���������Ϊa;����A��B��C��ʼͶ������ʵ����ֱ�Ϊn(A)��n(B)��n(C)������ͬ�����´ﵽƽ��ʱ��C���������ҲΪA�������й�������ȷ����