��Ŀ����
 ��1��ͼ1װ�÷�����Ӧ�����ӷ���ʽΪ���������������������������������������� ��
��1��ͼ1װ�÷�����Ӧ�����ӷ���ʽΪ���������������������������������������� ��
 ��2��ͼ2װ���м��ձ�ʢ��100 mL 0.2 mol��L��1��NaCl��Һ�����ձ�ʢ��100 mL 0.5 mol��L��1L��CuSO4��Һ����Ӧһ��ʱ���ֹͣͨ�硣����ձ��е��뼸�η�̪��Һ���۲쵽ʯī�缫�������ȱ�졣
��2��ͼ2װ���м��ձ�ʢ��100 mL 0.2 mol��L��1��NaCl��Һ�����ձ�ʢ��100 mL 0.5 mol��L��1L��CuSO4��Һ����Ӧһ��ʱ���ֹͣͨ�硣����ձ��е��뼸�η�̪��Һ���۲쵽ʯī�缫�������ȱ�졣
�� ��Դ��M��Ϊ���� �������ձ������缫��
�缫��ӦΪ�������������������� ��
 �� ���ձ��е�ⷴӦ�Ļ�ѧ����ʽΪ�������� ��������
�� ���ձ��е�ⷴӦ�Ļ�ѧ����ʽΪ�������� ��������
�� ֹͣ��⣬ȡ��Cu�缫��ϴ�ӡ�����������缫���� 0.64 g�����ձ��в����������״�������Ϊ�� ������ mL ��
��3��ͼ3���Ҵ�ȼ�ϵ�أ��������ҺΪKOH��Һ���ṹʾ��ͼ��
д�� a���ĵ缫��Ӧʽ������������������
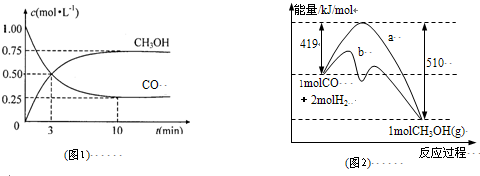
��1��2Fe3+ + Cu = 2Fe2+ + Cu2+��2�֣�
��2���� ����2�֣��� Fe - 2e-= Fe2+��2�֣�
�� 2CuSO4+ 2H2O![]() 2Cu + O2�� + 2H2SO4 ��2�֣� �� 224��2�֣�
2Cu + O2�� + 2H2SO4 ��2�֣� �� 224��2�֣�
��3��CH3CH2OH-12e-+16OH-= 2CO3 2-+11H2O��2�֣�

������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����ش��������⣺
��1����֪C(s)+H2O(g) CO(g)+H2(g)����÷�Ӧ��ƽ�ⳣ������ʽΪ ��
CO(g)+H2(g)����÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��2����֪��һ���¶��£�
C��s��+CO2��g��
 2CO��g��
��H1
2CO��g��
��H1
CO��g��+H2O��g��
 H2��g��+CO2��g��
��H2
H2��g��+CO2��g��
��H2
C��s��+H2O��g�� CO��g��+H2��g�� ��H3
CO��g��+H2��g�� ��H3
���H1����H2����H3֮��Ĺ�ϵ�ǣ� ��
��3��ͨ���о���ͬ�¶���ƽ�ⳣ�����Խ��ijЩʵ�����⡣��֪�������һ����̼��ˮ�������뷴Ӧʱ���ᷢ�����·�Ӧ�� CO(g)+H2O(g)  H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯�����ʾ��
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯�����ʾ��
|
�¶�/�� |
400 |
500 |
800 |
|
ƽ�ⳣ��K |
9.94 |
9 |
1 |
��÷�Ӧ������Ӧ������ ��Ӧ������ȡ����ȡ�������500��ʱ��������ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020mol/L����CO��ƽ��ת����Ϊ ��
��4���Ӱ����������������ᣬ�˹������漰���������NO��NO2��N2O4�ȡ��Է�ӦN2O4(g)  2NO2(g)
��H��0���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���� ��
2NO2(g)
��H��0���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ���� ��

A��A��C����ķ�Ӧ���ʣ�A��C
B��A��C�����������ɫ��A�Cdz
C��B��C����������ƽ����Է���������B��C
D����״̬A��״̬B�������ü��ȵķ���
E��A��C����Ļ�ѧƽ�ⳣ����A=C
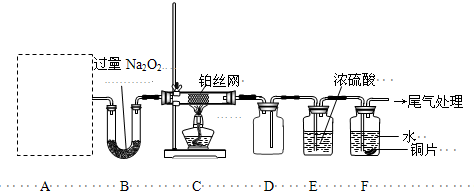
��5����ҵ����Na2SO3����β���е�SO2��������ͼװ�õ��(���Ե缫)NaHSO3��ȡH2SO4�������ӽ���Ĥֻ����������ͨ�����������缫��ӦʽΪ�� ���������ݳ�����ijɷ�Ϊ ���ѧʽ����





 ���ڣ��ټ���1.1gKI��������ҡ�ȣ��ڰ�������5���Ӻ���1mLָʾ������0.0250mol/L�����������Һ�ζ����յ㣬ƽ�вⶨ���Σ�ƽ�����ı������������Һ24.00mL��
���ڣ��ټ���1.1gKI��������ҡ�ȣ��ڰ�������5���Ӻ���1mLָʾ������0.0250mol/L�����������Һ�ζ����յ㣬ƽ�вⶨ���Σ�ƽ�����ı������������Һ24.00mL��