题目内容
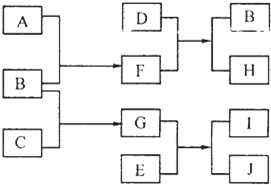 A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);
A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);请回答下列问题:
(1)元素B在周期表的位置是
(2)写出D与F反应的化学方程式:
(3)H是一种典型的
(4)若参加反应的E足量,生成的J中含有组成B的元素,则检验化合物J中阳离子的化学方法(有必要的文字叙述和相应的离子方程式)是:
分析:D与F反应生成B与H,放出大量的热,该反应属于置换反应,且B、D是金属,考虑为铝热反应,初步判断D为Al、H为Al2O3,A常温下为气态的单质,结合转化关系可知A为O2、B为Fe、F为Fe3O4.E的摩尔质量是A的2倍,则E为Cu,由转化关系可知G中含有Fe元素,能与Cu反应生成两种化合物,则G中Fe为高价态,又由C常温下为气体单质,与Fe反应生成G,可推知C为Cl2、G为FeCl3,若J中含有B元素,则J为FeCl2,I为CuCl2,验证符合转化关系,据此解答.
解答:解:D与F反应生成B与H,放出大量的热,该反应属于置换反应,且B、D是金属,考虑为铝热反应,初步判断D为Al、H为Al2O3,A常温下为气态的单质,结合转化关系可知A为O2、B为Fe、F为Fe3O4.E的摩尔质量是A的2倍,则E为Cu,由转化关系可知G中含有Fe元素,能与Cu反应生成两种化合物,则G中Fe为高价态,又由C常温下为气体单质,与Fe反应生成G,可推知C为Cl2、G为FeCl3,若J中含有B元素,则J为FeCl2,I为CuCl2,验证符合转化关系,
(1)由上述分析可知,B为Fe,处于周期表中第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)D与F反应的化学方程式为:3Fe3O4+8Al
9Fe+4Al2O3,该反应在工业生产中可以用来冶炼难熔金属,H与烧碱溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:3Fe3O4+8Al
9Fe+4Al2O3;用来冶炼难熔金属等;
(3)H为Al2O3,属于典型的两性氧化物,与烧碱溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:两性;Al2O3+2OH-=2AlO2-+H2O;
(3)若J中含有B元素,则J为FeCl2,I为CuCl2,检验Fe2+离子:取少许J溶液与试管中,先加入滴加KSCN溶液,无明显现象,再滴加氯水,发生反应:Cl2+2Fe2+=2Fe3++2Cl-、3SCN-+Fe3+=Fe(SCN)3,溶液呈红色,
故答案为:取少许J溶液与试管中,先加入滴加KSCN溶液,无明显现象,再滴加氯水,发生反应:Cl2+2Fe2+=2Fe3++2Cl-、3SCN-+Fe3+=Fe(SCN)3,溶液呈红色.
(1)由上述分析可知,B为Fe,处于周期表中第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)D与F反应的化学方程式为:3Fe3O4+8Al
| ||
故答案为:3Fe3O4+8Al
| ||
(3)H为Al2O3,属于典型的两性氧化物,与烧碱溶液反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:两性;Al2O3+2OH-=2AlO2-+H2O;
(3)若J中含有B元素,则J为FeCl2,I为CuCl2,检验Fe2+离子:取少许J溶液与试管中,先加入滴加KSCN溶液,无明显现象,再滴加氯水,发生反应:Cl2+2Fe2+=2Fe3++2Cl-、3SCN-+Fe3+=Fe(SCN)3,溶液呈红色,
故答案为:取少许J溶液与试管中,先加入滴加KSCN溶液,无明显现象,再滴加氯水,发生反应:Cl2+2Fe2+=2Fe3++2Cl-、3SCN-+Fe3+=Fe(SCN)3,溶液呈红色.
点评:本题考查无机物推断,题目没有明显的突破口,属于猜测验证型推断,需要学生熟练掌握元素化合物知识,综合考查学生的应用分析能力,难度较大.

练习册系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
