题目内容
15.①pH=2的CH3COOH溶液;②pH=2的盐酸;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
分析 A.温度不变,水的离子积常数不变,根据溶液的PH值计算水电离的氢离子浓度;
B.pH=2的HCl溶液和pH=12的氨水中,氨水浓度大于盐酸;
C.醋酸为弱酸,弱酸存在电离平衡,随反应进行电离出的氢离子继续和铝反应;
D.加水稀释,强酸强碱溶液的pH变化最大,若酸弱碱存在电离平衡稀释促进电离.
解答 解:A.①、②的氢离子浓度相同,③、④的氢氧根离子的浓度相同,四种溶液的离子浓度相同,相同条件下,水的离子积常数是定值,无论酸还是碱都抑制水的电离,所以这四种溶液中由水电离的c(H+):①=②=③=④,故A正确;
B.氨水是弱碱只有部分电离,所以c(NH3•H2O)>c(OH-),氯化氢是强电解质,所以其溶液中c(HCl)=c(H+),c(NH3•H2O)>c(HCl),若将氨水和盐酸混合后溶液呈中性,则消耗溶液的体积:②>③,故B错误;
C.醋酸是弱酸,氯化氢和氢氧化钠是强电解质,①、②、④三种溶液的物质的量浓度关系为:①>②=④,所以等体积的①、②、④溶液分别与铝粉反应,生成H2的量:①最大,故C错误;
D.醋酸是弱酸,加水稀释后能促进醋酸的电离,所以①、②稀释后溶液的pH值7>②>①;氨水是弱碱,加水稀释后能促进氨水的电离,所以③、④、稀释后溶液的pH值③>④>7,所以向等体积的四种溶液中分别加入100mL水后,溶液的pH:③>④>②>①,故D错误.
故选A.
点评 本题考查了弱电解质的电离、溶液稀释后pH值相对大小的比较等知识点,侧重于学生的分析能力的考查,为高频考点,易错选项是A,注意无论是水溶液还是碱溶液都抑制水的电离,盐类的水解能促进水的电离,难度中等.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
5.关于CO2说法正确的是( )
| A. | 碳原子采取sp杂化 | B. | CO2晶胞是体心结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
3.一定温度下,在三个体积均为2.0L的恒容密闭容器中发生如下反应:
PCl5(g)?PCl3(g)+Cl2(g)
下列说法正确的是( )
PCl5(g)?PCl3(g)+Cl2(g)
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=$\frac{0.10}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
10.盛满NO、NO2、O2混合气体的大试管倒置于盛水的水槽中,水面上升且充满试管,则NO、NO2、O2三种气体的体积比不可能是( )
| A. | 5:6:7 | B. | 1:1:1 | C. | 4:8:5 | D. | 8:4:7 |
20.一定温度下,向2.0L恒容密闭容器中充入1.0mol A,经一段时间后反应A(g)?B(g)+C(g)达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50 s内B的平均反应速率v(B)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,若达到平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0 mol A、0.20 mol B和0.20 mol C,则达到平衡前v(正)>v(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2 mol•L-1,则反应的△H<0 |
7.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)A原子的核外电子排布式
1s22s22p63s1.
(2)B元素在周期表中的位置第三周期第ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是 .
.
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O_,与D的氢化物的水化物反应的化学方程式为3HCl+Al(OH)3═AlCl3+3H2O.
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式
1s22s22p63s1.
(2)B元素在周期表中的位置第三周期第ⅢA族;离子半径:B小于A(填“大于”或“小于”).
(3)C原子的电子排布图是
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.(4)D原子的电子排布式为1s22s22p63s23p5或[Ne]3s23p5,D-的结构示意图是
 .
.(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+3HClO4═Al(ClO4)3+3H2O_,与D的氢化物的水化物反应的化学方程式为3HCl+Al(OH)3═AlCl3+3H2O.
4.某科研小组发现一种新型的有机物--全氟丙烷(C3F8),下列有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处在同一直线上 | |
| B. | 它的五氯代物数目与三氯代物的数目相等 | |
| C. | 它属于烃类 | |
| D. | 该物质易溶于水,难溶于有机物 |
 ④
④ ⑤
⑤ ⑥CH3-CH═CH2 ⑦
⑥CH3-CH═CH2 ⑦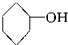 ⑧
⑧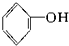 ⑨
⑨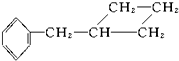 中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.
中,属于环状化合物的是③⑤⑦⑧⑨,属于脂环化合物的是⑤⑦,属于芳香化合物的是③⑧⑨,属于脂肪烃的是①②④⑥.