题目内容
 如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:
如图所示,A、B两个装置中两个烧杯分别盛有足量的CuCl2溶液:(1)A、B两个装置中属于原电池的是
(2)A池中Zn是
(3)B池中左边碳棒是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)把电能转化为化学能的装置是电解池,所以电解池有外接电源;
(2)A为原电池,锌为负极,发生氧化反应,铜为正极,发生还原反应;
(3)B为电解池,阳极发生氧化反应生成氯气,阴极发生还原反应生成铜.
(2)A为原电池,锌为负极,发生氧化反应,铜为正极,发生还原反应;
(3)B为电解池,阳极发生氧化反应生成氯气,阴极发生还原反应生成铜.
解答:
解:(1)A为原电池,B外加电源,应为电解池,故答案为:A;B;
(2)A为原电池,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,
故答案为:负;氧化;Zn-2e-=Zn2+;Cu2++2e-=Cu;
(3)B为电解池,左边碳棒连接电源负极,为电解池的阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,右边碳棒为阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,若通电过程中有0.2mol电子转移,则析出0.1mol铜,质量为6.4g,生成0.1mol氯气,体积为0.01mol×22.4L/mol=2.24L,
故答案为:阴;还原;2Cl--2e-=Cl2↑;6.4;2.24.
(2)A为原电池,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,
故答案为:负;氧化;Zn-2e-=Zn2+;Cu2++2e-=Cu;
(3)B为电解池,左边碳棒连接电源负极,为电解池的阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,右边碳棒为阳极,发生氧化反应,电极方程式为2Cl--2e-=Cl2↑,若通电过程中有0.2mol电子转移,则析出0.1mol铜,质量为6.4g,生成0.1mol氯气,体积为0.01mol×22.4L/mol=2.24L,
故答案为:阴;还原;2Cl--2e-=Cl2↑;6.4;2.24.
点评:本题考查原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池和电解池的工作原理,把握电极方程式的书写,难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
下列离子方程式书写正确的是( )
| A、Cl2通入Na2SO3溶液:2Cl2+H2O+SO32-═2HClO+SO2↑+2Cl- |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
C、水杨酸(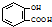 )中加入Na2CO3溶液: )中加入Na2CO3溶液: +CO32-→ +CO32-→ +CO2↑+H2O +CO2↑+H2O |
| D、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ |
下列离子方程式书写正确的是( )
| A、碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
| B、铜溶解于氯化铁溶液中:2Fe3++3Cu═2Fe+3Cu2+ |
| C、氯化铝溶液与过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、FeSO4溶液中滴入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
 A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题:
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题: