题目内容
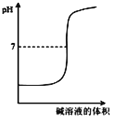
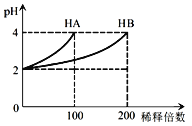
【题目】常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
A.HA的电离方程式为HA![]() H++A-
H++A-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.0.1mol/L NaB溶液中: c(H+)= c(OH-)+c(HB)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
【答案】B
【解析】
A、根据图像曲线变化可知,将pH=2的HA稀释100倍后,溶液的pH=4,所以HA为强酸,在溶液中能完全电离,故电离方程式为HA=H++A-,A错误;
B、由于HA为强酸,而稀释前pH=2,故稀释前的c(HA)=0.01 molL-1,而HB为弱酸,故当pH=2时,所需的c(HB)大于0.01 molL-1,故c(HB)>c(HA)=0.01 molL-1,B正确;
C、由于HB为弱酸,故NaB为强碱弱酸盐,B-在溶液中会部分水解为HB,而溶液中所有的氢离子和氢氧根均来自于水,根据质子守恒可知:c(OH-)=c(H+)+c(HB),C错误;
D、对于NaA,有c(Na+)=c(A-),而对于NaB溶液,则有:c(Na+)=c(B-)+c(HB),由于不能确定二者的组织比例,因此在NaA和NaB的混合溶液中,不一定有2c(Na+)=c(A-)+c(B-)+c(HB),D错误;
答案选B。

【题目】某学生用0.1500mol/LNaOH溶液测定某未知浓度的盐酸,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2-3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2-3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写): → →F→ → → →D;___
(2)操作F中应该选择图中滴定管___(填标号)。
![]()
(3)滴定终点的现象是___。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为___(保留4位有效数字)。
(5)下列操作会导致测定结果偏高的是___。
A.用酸式滴定管向锥形瓶中放盐酸时,先仰视后平视读数
B.锥形瓶用盐酸润洗
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)已知若c(NH4Cl)<0.1mol·L-1,则pH>5.1,常温下若用0.1mol·L-1盐酸滴定10mL0.05mol·L-1氨水,甲基橙作指示剂,达到终点时所用盐酸的量应是___5mL(填“>”或“<”或“=”)。
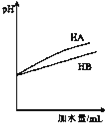
【题目】I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:

(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________( ![]() )。
)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
(4)若同pH同体积的下列溶液:①醋酸溶液;②盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _______________(填序号)。
Ⅱ.重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0,ρ=1 g/mL)中含有
Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S |
Ksp | 8.3×1012 | 5.6×108 | 6.3×1050 |
难溶电解质 | PbI2 | Pb(OH)2 | PbS |
Ksp | 7.1×109 | 1.2×1015 | 3.4×1028 |
(1)你认为往废水中加入________(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____。
(3)如果用食盐处理只含Ag+的废水,测得处理后的废水(ρ=1 g/mL)中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1×108mol/L,问该工厂处理后的废水中Ag+是否符合排放标准? _______已知Ksp(AgCl)=1.8×1010。