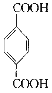
题目内容
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是![]()
选项 | 实验 | 现象 | 结论 |
A | 向2mL | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B | 往 | 产生白色胶状沉淀 | 酸性: |
C | 常温下将铝片加入浓硝酸中 | 无明显现象 | 铝与浓硝酸不反应 |
D | 将 | 紫色溶液褪色 |
|
A.AB.BC.CD.D
【答案】A
【解析】
![]() 与氯化铁反应生成氯化亚铁,则黄色逐渐消失,加KSCN溶液颜色不变,还原性:
与氯化铁反应生成氯化亚铁,则黄色逐渐消失,加KSCN溶液颜色不变,还原性:![]() ,故A正确;
,故A正确;
B.往![]() 溶液中通入足量
溶液中通入足量![]() 气体,产生硅酸白色胶状沉淀,说明碳酸的酸性较强,即酸性:
气体,产生硅酸白色胶状沉淀,说明碳酸的酸性较强,即酸性:![]() ,故B错误;
,故B错误;
C.常温下将铝片加入浓硝酸中,发生钝化现象,阻止了反应的进行,不是没有反应,故C错误;
D.将![]() 溶液滴加到酸性
溶液滴加到酸性![]() 溶液中,发生氧化还原反应,高锰酸钾被过氧化氢还原,紫色溶液褪色,过氧化氢表现了还原性,故D错误;
溶液中,发生氧化还原反应,高锰酸钾被过氧化氢还原,紫色溶液褪色,过氧化氢表现了还原性,故D错误;
故选:A。

【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚( CH3OCH3)。请回答下列问题:
(1)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol
总反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:________(填字母代号)。
a.压缩体积 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度e.分离出二甲醚(CH3OCH3)
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小比较:![]() _________
_________![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②该反应的平衡常数的表达式为K=_____,温度升高,该反应的平衡常数K____(填“增大”、“减小”或“不变”)