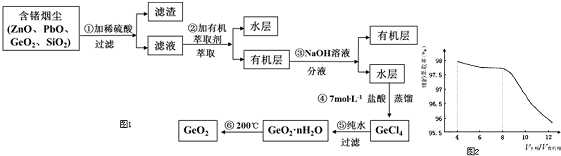
题目内容
19.下列叙述正确的是( )| A. | 原子晶体中只存在非极性共价键 | |
| B. | 甲烷?氨和水都是由极性键结合而成的极性分子 | |
| C. | 金属晶体的熔点一定比原子晶体低,比分子晶体高 | |
| D. | H2O的沸点比H2S高,是因为H2O分子间存在氢键 |
分析 A.原子晶体中可能存在极性共价键;
B.甲烷属于非极性分子;
C.金属晶体的熔点不一定比分子晶体高;
D.氢键导致物质的熔沸点升高.
解答 解:A.原子晶体中可能存在极性共价键,如SiC中存在极性共价键,故A错误;
B.甲烷分子中正负电荷中心重合,所以属于非极性分子,故B错误;
C.金属晶体的熔点不一定比分子晶体高,如汞的熔点低于水,故C错误;
D.氢键导致物质的熔沸点升高,水分子之间能形成氢键、硫化氢分子之间不能形成氢键,所以H2O的沸点比H2S高,故D正确;
故选D.
点评 本题考查化学键、分子极性的判断、晶体熔沸点判断等知识点,明确晶体的构成微粒及微粒之间作用力即可解答,注意氢键只影响物理性质不影响化学性质,会采用举例法分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
| A. | 金属元素 | B. | 非金属元素 | ||
| C. | 稀有气体元素 | D. | 无法确定为哪一类元素 |
14.下列有关工业生产叙述正确的是( )
| A. | 电解精炼铜时,将粗铜与电源的负极相连 | |
| B. | 合成氨工业中,将NH3及时液化分离有利于加快反应速率 | |
| C. | 氯碱工业中,烧碱在阳极区生成 | |
| D. | 工业上通常使用电解法制备金属钠、镁、铝等 |
4.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
图Ⅰ所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了27g.常温下各烧杯中溶液的pH与电解时间t的关系如图Ⅱ所示.据此回答下列问题:
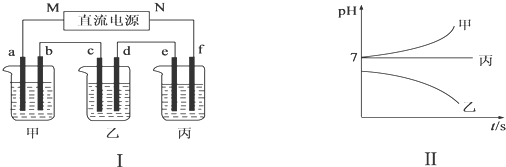
(1)M为电源的负(填“正”或“负”)极,乙中阳离子向c(填“c”或“d”)定向移动,A是NaCl(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积为1.4L.
(3)b电极上发生的电极反应为2Cl--2e-=Cl2↑;乙烧杯的电解池总反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)要使丙恢复到原来的状态,应加入物质的质量为2.25g.
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |

(1)M为电源的负(填“正”或“负”)极,乙中阳离子向c(填“c”或“d”)定向移动,A是NaCl(填写化学式).
(2)计算电极f上生成的气体在标准状况下的体积为1.4L.
(3)b电极上发生的电极反应为2Cl--2e-=Cl2↑;乙烧杯的电解池总反应的化学方程式为4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3.
(4)要使丙恢复到原来的状态,应加入物质的质量为2.25g.
8.短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等.下列判断正确的是( )
| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
9.下列有关物质的性质和该性质的应用均正确的是( )
| A. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| B. | 油脂在碱性条件下易水解,可用于制作肥皂 | |
| C. | 次氯酸钠具有强还原性,可用于配制“84”消毒液 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
 的名称为3,3,6-三甲基辛烷;
的名称为3,3,6-三甲基辛烷;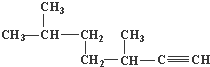 的名称为3,6-二甲基-1-庚炔;
的名称为3,6-二甲基-1-庚炔; ;
;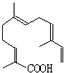 所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应.
所示,分子式为C15H22O2;该物质可以与下列ABCD(填序号)发生反应. 中含有的官能团的名称为羟基,酯基.
中含有的官能团的名称为羟基,酯基. .
.