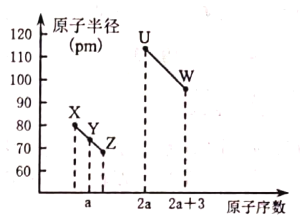
题目内容
【题目】用![]() 、
、![]() 可以制备含有
可以制备含有![]() 的
的![]() 悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米![]() 。
。
(1)基态![]() 的核外电子排布式为__________。
的核外电子排布式为__________。
(2)与![]() 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。
(3)![]() 与
与![]() 反应能生成
反应能生成![]() ,
,![]() 中的配位原子为________(填元素符号)。
中的配位原子为________(填元素符号)。
(4)乙醛(![]() )中碳原子的轨道杂化类型是_________;
)中碳原子的轨道杂化类型是_________;![]() 中含有
中含有![]() 键的数目为________
键的数目为________![]() 。
。
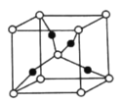
(5)一个![]() 晶胞(见图)中,
晶胞(见图)中,![]() 原子的数目为________。
原子的数目为________。
【答案】![]() 或
或![]() HF O
HF O ![]() 、
、![]() 6 4
6 4
【解析】
(1)根据核外电子排布规律书写;
(2)根据等电子体的概念解答;
(3)根据配位键的概念分析;
(4)根据轨道杂化理论分析;
(5)根据晶胞的结构分析计算。
(1)Cu为29号元素,基态Cu原子的核外电子排布式为![]() 或
或![]() ,Cu原子失去4s轨道的1个电子和3d轨道的1个电子后变成
,Cu原子失去4s轨道的1个电子和3d轨道的1个电子后变成![]() ,故基态
,故基态![]() 的核外电子排布式为
的核外电子排布式为![]() 或
或![]() ;
;
(2)原子总数相同、价电子总数相同的分子或离子互为等电子体,与![]() 互为等电子体的一种分子可以为HF;
互为等电子体的一种分子可以为HF;
(3)![]() 与
与![]() 反应能生成
反应能生成![]() ,
,![]() 中Cu2+提供空轨道,O原子提供孤电子对形成配位键,所以
中Cu2+提供空轨道,O原子提供孤电子对形成配位键,所以![]() 中的配位原子为O;
中的配位原子为O;
(4)乙醛(![]() )中甲基上的C原子形成4个σ键,无孤电子对,价层电子对数为4,故甲基上的C原子采取sp3杂化;醛基中的C原子形成3个σ键,无孤电子对,价层电子对数为3,故醛基上的C原子采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6mol σ键;
)中甲基上的C原子形成4个σ键,无孤电子对,价层电子对数为4,故甲基上的C原子采取sp3杂化;醛基中的C原子形成3个σ键,无孤电子对,价层电子对数为3,故醛基上的C原子采取sp2杂化;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6mol σ键;
(5)一个![]() 晶胞中,白球的个数为
晶胞中,白球的个数为![]() ,黑球的个数为4,又Cu2O中Cu和O的个数比为2:1,故白球为O原子,黑球为Cu原子,故一个
,黑球的个数为4,又Cu2O中Cu和O的个数比为2:1,故白球为O原子,黑球为Cu原子,故一个![]() 晶胞中,
晶胞中,![]() 原子的数目为4。
原子的数目为4。

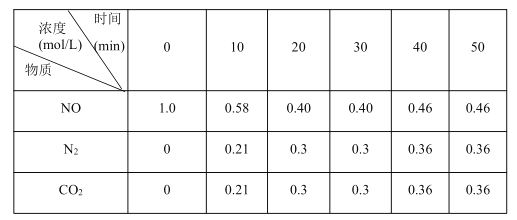
【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为放热反应
B.达平衡时,容器Ⅱ中CH3OCH3的浓度大于0.16 mol/L
C.达平衡时,容器Ⅲ中![]() 比容器Ⅱ中的大
比容器Ⅱ中的大
D.若起始时向容器Ⅰ中充入CH3OH(g)0.30 mol、CH3OCH3(g)1.50 mol和H2O(g)0.30 mol,则反应将向逆反应方向进行