题目内容
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质.实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
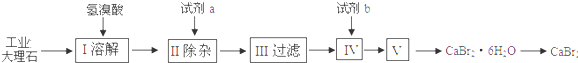
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、 、 .
(2)已知步骤Ⅲ的滤液中不含NH4+.步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 .步骤Ⅳ的目的是 .
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、干燥、称量.若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数).
②若实验操作规范而测定结果偏低,其原因是 .

完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、
(2)已知步骤Ⅲ的滤液中不含NH4+.步骤Ⅱ加入的试剂a是
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、干燥、称量.若得到1.88g碳酸钙,则溴化钙的质量分数为
②若实验操作规范而测定结果偏低,其原因是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:大理石和氢溴酸反应生成溴化钙,因含有少量Al3+、Fe3+等杂质,可加入石灰水,沉淀Al3+、Fe3+,过滤后得到溴化钙、氢氧化钙的混合溶液,加入试剂b为氢溴酸,可除去过量的氢氧化钙,然后经蒸发、浓缩、冷却结晶可得到溴化钙晶体,以此解答该题.
解答:
解:大理石和氢溴酸反应生成溴化钙,因含有少量Al3+、Fe3+等杂质,可加入石灰水,沉淀Al3+、Fe3+,过滤后得到溴化钙、氢氧化钙的混合溶液,加入试剂b为氢溴酸,可除去过量的氢氧化钙,然后经蒸发、浓缩、冷却结晶可得到溴化钙晶体,
(1)配制溶液,需要玻璃棒、烧杯、量筒、胶头滴管以及500ml容量瓶,故答案为:胶头滴管;500ml容量瓶;
(2)步骤Ⅲ的滤液中不含NH4+.则应加入石灰水生成氢氧化铝、氢氧化铁沉淀,加入试剂b为氢溴酸,可除去过量的氢氧化钙,
故答案为:石灰水;沉淀Al3+、Fe3+;除去过量的氢氧化钙;
(3)CaBr2~CaCO3
200 100
3.76g 1.88g
故CaBr2的质量为3.76g,质量分数为=
×=0.94;
溴化钙易吸水,因此造成测定结果偏低,
故答案为:94%;溴化钙吸水.
(1)配制溶液,需要玻璃棒、烧杯、量筒、胶头滴管以及500ml容量瓶,故答案为:胶头滴管;500ml容量瓶;
(2)步骤Ⅲ的滤液中不含NH4+.则应加入石灰水生成氢氧化铝、氢氧化铁沉淀,加入试剂b为氢溴酸,可除去过量的氢氧化钙,
故答案为:石灰水;沉淀Al3+、Fe3+;除去过量的氢氧化钙;
(3)CaBr2~CaCO3
200 100
3.76g 1.88g
故CaBr2的质量为3.76g,质量分数为=
| 3.76g |
| 4g |
溴化钙易吸水,因此造成测定结果偏低,
故答案为:94%;溴化钙吸水.
点评:本题以工艺流程的形式考查化学实验基本操作、计算、操作目的、误差分析等,难度中等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
常温下,对于下列电解质溶液的说法正确的是( )
| A、pH=1的溶液中,Fe3+、I-、NO3-、K+可以大量共存 |
| B、用过量的NaOH溶液吸收SO2的离子方程式:SO2+OH-=HSO3- |
| C、在c(SO32-)=0.1 mol.L-1的溶液中,Na+、C1-、H+、Ca2+可以大量共存 |
| D、向澄清石灰水中通入氯气,反应的离子方程式:2OH-+Cl2=C1-+C1O-+H2O |
下列反应中,H2O2只表现氧化性的是( )
A、2H2O2
| ||||
| B、H2O2+2Fe3+═2Fe2++2H++O2↑ | ||||
| C、H2O2+SO2═H2SO4 | ||||
| D、H2O2+2Fe2++2H+═2Fe3++2H2O |


 在虚线处开环聚合得
在虚线处开环聚合得 (此聚合物用作表面活性剂,)则开环
(此聚合物用作表面活性剂,)则开环 聚合得
聚合得

 用如图装置实验,下列实验现象预期及相应结论均正确的是( )
用如图装置实验,下列实验现象预期及相应结论均正确的是( )