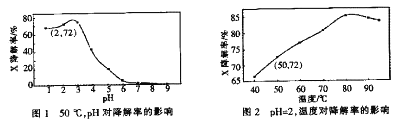
题目内容
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:
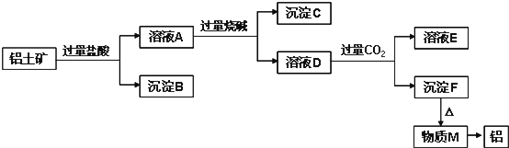
请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为____________________;
(2)由物质M制取铝的化学方程式为____________________;
(3)溶液D中通入过量CO2生成沉淀F的离子方程式为____________________;
(4)取一定量的沉淀C置于试管中,逐滴向试管中加入过量HI至沉淀全部溶解,所得溶液中Fe元素以_______存在,检验该离子的实验操作和现象是________________。
【答案】 Al3++4OH-=AlO2-+2H2O 2Al2O3![]() 4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe2+ 取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在。
4Al + 3O2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- Fe2+ 取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在。
【解析】(1)溶液A与转化为溶液D的离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(2)根据流程图沉淀F为氢氧化铝,氢氧化铝受热分解生成氧化铝和水,反应为:2Al(OH)3![]() Al2O3+3H2O,M为Al2O3,电解熔融的氧化铝可以制取铝,方程式为:2Al2O3
Al2O3+3H2O,M为Al2O3,电解熔融的氧化铝可以制取铝,方程式为:2Al2O3![]() 4Al + 3O2↑,故答案为:2Al2O3
4Al + 3O2↑,故答案为:2Al2O3![]() 4Al + 3O2↑;
4Al + 3O2↑;
(3)溶液A中含有镁离子、铁离子和铝离子、氢离子,加入过量烧碱,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,所以溶液D中含偏铝酸根离子,通入过量CO2和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)取一定量的沉淀C中含有氢氧化镁和氢氧化铁,置于试管中,逐滴向试管中加入过量HI至沉淀全部溶解,溶解生成的铁离子能够将碘离子氧化,铁离子被还原为亚铁离子,检验亚铁离子可以取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在,故答案为:Fe2+;取少量溶液于试管中,向该试管中滴加KSCN,溶液不变色,继续滴加氯水后溶液显红色,说明Fe元素以Fe2+存在。

【题目】工业合成硝酸的基础是NH3的催化氧化,某实验小组实验室中对该反应进行了探究。回答下列问题:
(1)气体制备与净化
①实验室常采用装置甲制备干燥纯净的NH3,则制取NH3的化学方程式___________________,仪器B中选取的试剂是______________(名称)。

②该小组采用KClO3 MnO2制备纯净的O2,通过查阅资料,发现该方法制备的O2中含有Cl2杂质。图乙是该小组制备纯净O2时可能用到的装置。装置连接顺序为C![]() ______ (部分仪器可重复使用),其中除去Cl反应的化学方程式为_________。
______ (部分仪器可重复使用),其中除去Cl反应的化学方程式为_________。
(2)氨的催化氧化
打开图中活塞h和活塞i,将(1)中制备的纯净NH3、O2 (O2过量) 通入到F装置中,喷灯加热,观察现象。
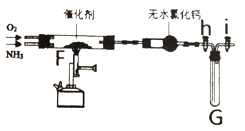
操作步骤 | 实验现象 | 解释原因 |
待铂粉为红热状态,停止加热 | 铂粉持续红热,G试管内① _____________ | ②__________ |
关闭活塞h和活塞i,取下装置 G,将该装置置于冷水中 | G中试管内③__________ | ④__________ |