题目内容
下表列出了3种燃煤烟气脱硫方法的原理.

(1)方法Ⅰ中氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2+H2O=(NH4)2SO3(NH4)2SO3+SO2+H2O=2NH4HSO3能提高燃煤烟气中SO2去除率的措施有______(填字母).
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D.通入空气使HSO3-转化为SO42-
采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的CO2,原因是______(用离子方程式表示).
(2)方法Ⅱ重要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g)△H=8.0kJ?mol-1
2H2(g)+SO2(g)=S(g)+2H2O(g)△H=90.4kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
S(g)与O2(g)反应生成SO2(g)的热化学方程式为______.
(3)方法Ⅲ中用惰性电极电解NaHSO3溶液的装置如右图所示.阳极区放出气体的成分为______.(填化学式)
解:(1)提高SO2的转化率,可以增大氨水的浓度、与氨水充分接触;不需要通入CO2的原因是因为HCO3-+SO2=CO2+HSO3-而产生CO2,故答案为:A、C;HCO3-+SO2=CO2+HSO3-;
(2)根据以下反应①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=8.0kJ?mol-1②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=90.4kJ?mol-1③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
④2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,利用盖斯定律,③-①或④-②可得到S(g)与O2(g)反应生成SO2(g)的热化学方程式为
S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1故答案为:S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1;
(3)电解时,阳极发生氧化反应,有O2生成,同时在阳极区加入稀硫酸,会有SO2,故答案为:O2、SO2.
分析:(1)提高SO2的转化率,可以增大氨水的浓度、与氨水充分接触;不需要通入CO2的原因是因为HCO3-+SO2=CO2+HSO3-而产生CO2,不影响的SO2吸收;
(2)利用盖斯定律,适当变形,可以得出S(g)与O2(g)反应生成(g)的热化学方程式;
(3)阴极发生还原反应,阳极发生氧化反应,有O2生成,同时在阳极区加入稀硫酸,会有SO2,电极产生的气体为O2和SO2.
点评:本题考察的知识覆盖面比较多,涉及到环境保护、盖斯定律、热化学方程式、离子方程式、电极方程式等内容,注意反应热的计算,不要忽视热化学方程式的书写的注意事项.
(2)根据以下反应①2CO(g)+SO2(g)=S(g)+2CO2(g)△H=8.0kJ?mol-1②2H2(g)+SO2(g)=S(g)+2H2O(g)△H=90.4kJ?mol-1③2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1
④2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,利用盖斯定律,③-①或④-②可得到S(g)与O2(g)反应生成SO2(g)的热化学方程式为
S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1故答案为:S(g)+O2(g)=SO2(g)△H═-574.0kJ?mol-1;
(3)电解时,阳极发生氧化反应,有O2生成,同时在阳极区加入稀硫酸,会有SO2,故答案为:O2、SO2.
分析:(1)提高SO2的转化率,可以增大氨水的浓度、与氨水充分接触;不需要通入CO2的原因是因为HCO3-+SO2=CO2+HSO3-而产生CO2,不影响的SO2吸收;
(2)利用盖斯定律,适当变形,可以得出S(g)与O2(g)反应生成(g)的热化学方程式;
(3)阴极发生还原反应,阳极发生氧化反应,有O2生成,同时在阳极区加入稀硫酸,会有SO2,电极产生的气体为O2和SO2.
点评:本题考察的知识覆盖面比较多,涉及到环境保护、盖斯定律、热化学方程式、离子方程式、电极方程式等内容,注意反应热的计算,不要忽视热化学方程式的书写的注意事项.

练习册系列答案
相关题目
燃煤烟气的脱硫(除SO2)技术和脱硝(除NOx)技术是环境科学研究的热点.下表列出了目前科学家正致力于研究的3种燃煤烟气的脱硫技术和脱硝技术的原理.
| 方法Ⅰ | 用硫和氮的氧化物之间的相互转化联合进行的脱硫和脱硝技术 |
| 方法Ⅱ | 用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术 |
| 方法Ⅲ | 用电化学原理将SO2转化为重要的化工原料H2SO4的脱硫技术 |
NO2(g)+SO2(g)+H2O(l)=H2SO4(l)+NO(g)△H1
NO(g)+NO2(g)=N2O3(g)△H2
N2O3(g)+2H2SO4(l)=2NOHSO4(s)+H2O(l)△H3
4NOHSO4(s)+O2(g)+2H2O(l)=4H2SO4(l)+4NO2(g)△H4
2SO2(g)+O2(g)+2H2O(l)=2H2SO4(l)△H5
则△H1、△H2、△H3、△H4、△H5之间的关系为△H5=______.
(2)方法Ⅱ的脱硝机理如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示.
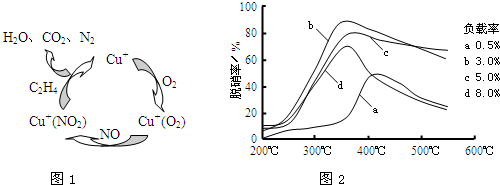
①出该脱硝过程中乙烯和NO2反应的化学方程式:______.
②达到最佳脱硝效果,应采取的条件是______.
(3)方法Ⅲ中用电化学原理将SO2转化为重要的化工原料H2SO4的装置如图(3)所示.
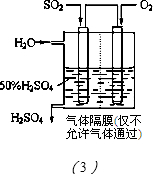
①写出通入SO2的电极的电极反应式:______.
②为使该脱硫过程稳定持续进行,硫酸溶液的浓度应维持不变,则通入的O2和加入的H2O的质量比为______.

 7N2+12H2O
7N2+12H2O  O+O2 Ⅱ、NO+O3→NO2+O2 Ⅲ、NO2+O→NO+O2
O+O2 Ⅱ、NO+O3→NO2+O2 Ⅲ、NO2+O→NO+O2 