题目内容
甲、乙两同学欲验证乙醇的性质,现做如下实验:
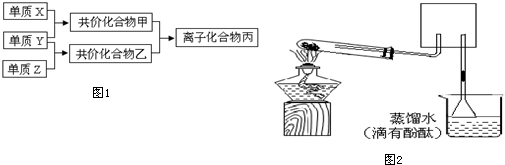
Ⅰ.甲同学做乙醇的催化氧化实验并考查催化剂的催化机理,现设计了如图1装置(夹持装置仪器已省略),

其实验操作为:先按图安装好,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象.试回答以下问题:
(1)A中发生反应的化学方程式: ,B的作用: ;C中热水的作用: .
(2)M处发生反应的化学方程式为: .
(3)从M管中可观察到的现象: .从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)了化学反应,还可以认识到催化剂起催化作用需要一定的 .
Ⅱ.乙同学进行乙醇的沸点测定实验,设计装置如图2,回答下列问题:
(1)盛乙醇的试管应浸入水浴中,水浴的温度应保持在 .
A.100℃B.78.5℃C.80℃D.50℃
(2)测乙醇沸点时为什么不把整个试管浸在水里? ;为什么塞子上要有个豁口? .
Ⅰ.甲同学做乙醇的催化氧化实验并考查催化剂的催化机理,现设计了如图1装置(夹持装置仪器已省略),

其实验操作为:先按图安装好,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体,即可在M处观察到明显的实验现象.试回答以下问题:
(1)A中发生反应的化学方程式:
(2)M处发生反应的化学方程式为:
(3)从M管中可观察到的现象:
Ⅱ.乙同学进行乙醇的沸点测定实验,设计装置如图2,回答下列问题:
(1)盛乙醇的试管应浸入水浴中,水浴的温度应保持在
A.100℃B.78.5℃C.80℃D.50℃
(2)测乙醇沸点时为什么不把整个试管浸在水里?
考点:乙醇的催化氧化实验
专题:实验题
分析:Ⅰ.(1)通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M;
(2)M处是乙醇的催化氧化反应生成乙醛;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜;催化剂参加反应过程,催化作用需要一定的温度;
Ⅱ.(1)乙醇的沸点(78.3℃),水浴温度应超过乙醇的沸点,使乙醇变为蒸气;
(2)因为将整个试管浸在沸水里所测的温度为沸水的温度而不是乙醇蒸气的温度;盛乙醇试管的塞子上留有豁口是使试管内外大气相通压强相等;
(2)M处是乙醇的催化氧化反应生成乙醛;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜;催化剂参加反应过程,催化作用需要一定的温度;
Ⅱ.(1)乙醇的沸点(78.3℃),水浴温度应超过乙醇的沸点,使乙醇变为蒸气;
(2)因为将整个试管浸在沸水里所测的温度为沸水的温度而不是乙醇蒸气的温度;盛乙醇试管的塞子上留有豁口是使试管内外大气相通压强相等;
解答:
解:Ⅰ.(1)打开分液漏斗活塞后,A中发生反应的化学方程式为:2H2O2
2H2O+O2↑,B是吸收氧气中的水蒸气;C是加热乙醇得到乙醇蒸气进入M,
故答案为:2H2O2
2H2O+O2↑;干燥O2;使D中乙醇变为蒸气进入M中参加反应;
(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O;
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;催化剂参加反应过程,催化作用需要一定的温度,
故答案为:受热部分的铜丝由于间歇性地鼓入氧气而交替出现变黑、变红的现象;参加;温度;
Ⅱ.(1)测乙醇沸点实验时应考虑必须使乙醇充分汽化,乙醇的沸点(78.5℃),水浴温度应超过乙醇的沸点,使乙醇变为蒸汽,所以水浴的温度应保持在100℃,
故答案为:A;
(2)测乙醇沸点时为什么不把整个试管浸在水里是因为若将整个试管浸在沸水里,所测的温度为沸水的温度,而不是乙醇蒸气的温度;
封闭系统受热后,将会发生过热、冲料、爆炸、着火(酒精可燃)等意外事故,盛乙醇试管的塞子上留有豁口是使试管内外大气相通,压强相等;
故答案为:因为若将整个试管浸在沸水里,所测的温度为沸水的温度,而不是乙醇蒸气的温度;盛乙醇试管的塞子上留有豁口是使试管内外大气相通,压强相等;
| ||
故答案为:2H2O2
| ||
(2)M处发生的反应是乙醇的催化氧化反应生成乙醛,反应的化学方程式为:2CH3CH2OH+O2
| Cu |
| △ |
故答案为:2CH3CH2OH+O2
| Cu |
| △ |
(3)铜丝做催化剂,和氧气反应生成氧化铜,和乙醇反应又生成铜,热部分的铜丝由于间歇性地鼓入空气而交替出现变黑,变红的现象;催化剂参加反应过程,催化作用需要一定的温度,
故答案为:受热部分的铜丝由于间歇性地鼓入氧气而交替出现变黑、变红的现象;参加;温度;
Ⅱ.(1)测乙醇沸点实验时应考虑必须使乙醇充分汽化,乙醇的沸点(78.5℃),水浴温度应超过乙醇的沸点,使乙醇变为蒸汽,所以水浴的温度应保持在100℃,
故答案为:A;
(2)测乙醇沸点时为什么不把整个试管浸在水里是因为若将整个试管浸在沸水里,所测的温度为沸水的温度,而不是乙醇蒸气的温度;
封闭系统受热后,将会发生过热、冲料、爆炸、着火(酒精可燃)等意外事故,盛乙醇试管的塞子上留有豁口是使试管内外大气相通,压强相等;
故答案为:因为若将整个试管浸在沸水里,所测的温度为沸水的温度,而不是乙醇蒸气的温度;盛乙醇试管的塞子上留有豁口是使试管内外大气相通,压强相等;
点评:本题考查了物质性质的实验方案的设计和分析判断,主要是乙醇的催化氧化反应的产物性质判断和反应现象应用,题目难度中等.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列有关烃的说法错误的是( )
| A、石油和天然气的主要成分都是碳氢化合物 |
| B、苯和乙烯都能与H2发生加成反应 |
| C、乙烯、氯乙烯、苯乙烯都可用于合成有机高分子材料 |
| D、苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
下列对于苯的叙述正确的是( )
| A、易被强氧化剂KMnO4等氧化 |
| B、属于不饱和烃易发生加成反应 |
| C、属于不饱和烃但比较易发生取代反应 |
| D、苯是一种重要的有机溶剂可广泛应用于生产绿色油漆等 |
下列溶液一定呈碱性的是( )
| A、c(OH-)>c(H+) |
| B、c(OH-)=1×10-6mol/L |
| C、使甲基橙变黄 |
| D、pH=8的溶液 |
 能用下列装置净化、并能进行验证的气体是( )
能用下列装置净化、并能进行验证的气体是( ) 某生物燃料电池结构示意图如图所示.请回答下列问题:
某生物燃料电池结构示意图如图所示.请回答下列问题: