题目内容
Na2O2是一种强氧化剂,H2是常用的还原剂.我们设想Na2O2与H2也能发生化学反应.某化学小组探究Na2O2与H2的反应,首先对Na2O2与H2的反应进行预测(方程式均未配平):①Na2O2+H2→NaOH②Na2O2+H2→Na+H2O
③Na2O2+H2→Na2O+H2O④Na2O2+H2→NaH+O2
⑤Na2O2+H2→NaOH+O2⑥Na2O2+H2→NaOH+H2O
(1)小组同学查阅相关资料,理论上说明Na2O2与H2在加热条件下能发生反应,从理论分析,上述①~⑥的预测中,合理的预测是
(2)化学小组设计实验证明自己的预测,实验装置如下:
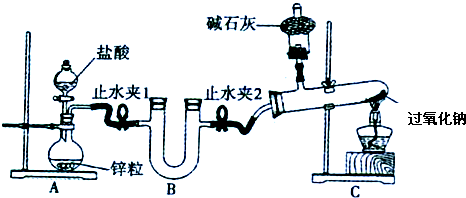
实验步骤(下列没有按操作顺序排列):a、在装置中装好相应的试剂;b、连接装置,检查装置的气密性;c、加热C装置中的过氧化钠;d、反应结束后,撤离酒精灯,等试管冷却后停止通氢气;e、打开止水夹,再打开A装置中的分液漏斗开关,通入氢气.
回答下列问题:
①实验步骤的正确操作顺序为
②B装置内应放的试剂是
③装置C中,通氢气进入试管内的导管没有画出,请在装置图内画出.
④实验发现过氧化钠在加热条件下与氢气可以反应,观察到C装置试管中的实验现象为
⑤用最简单的方法证明装置C中过氧化钠完全反应:
分析:(1)已知Na2O2是一种强氧化剂,H2是常用的还原剂,所以二者反应可能生成NaOH;
(2)①根据连接仪器的一般顺序分析,先检验气密性再加药品,再点燃酒精灯进行实验;
②根据实验目的分析,后面试管中是过氧化钠与氢气反应,为了防止水蒸气与过氧化钠反应,所以要干燥氢气;③C装置是防止空气中的水蒸气和二氧化碳进入与过氧化钠;
③装置C中,通氢气进入试管内的导管应该伸到试管底部;
④根据固体颜色的变化分析;
⑤过氧化钠能与水反应生成氧气.
(2)①根据连接仪器的一般顺序分析,先检验气密性再加药品,再点燃酒精灯进行实验;
②根据实验目的分析,后面试管中是过氧化钠与氢气反应,为了防止水蒸气与过氧化钠反应,所以要干燥氢气;③C装置是防止空气中的水蒸气和二氧化碳进入与过氧化钠;
③装置C中,通氢气进入试管内的导管应该伸到试管底部;
④根据固体颜色的变化分析;
⑤过氧化钠能与水反应生成氧气.
解答:解:(1)①Na2O2+H2→NaOH,已知Na2O2是一种强氧化剂,H2是常用的还原剂,所以二者反应可能生成NaOH;
②Na2O2+H2→Na+H2O,Na具有强还原性,氢气不能置换生成Na,所以不可能;
③Na2O2+H2→Na2O+H2O,Na2O与H2O会反应生成氢氧化钠,所以不可能;
④Na2O2+H2→NaH+O2,H2是常用的还原剂,反应中作氧化剂,所以不可能;
⑤Na2O2+H2→NaOH+O2,反应物中氢元素和氧元素化合价都升高,不符合氧化还原反应原理,
⑥Na2O2+H2→NaOH+H2O,已知Na2O2是一种强氧化剂,H2是常用的还原剂,所以二者反应可能生成NaOH,若有水则过氧化钠会与氧气会生成氧气,所以不可能;
故答案为:①;
(2)①根据连接仪器的一般顺序分析,先检验气密性再加药品,先通入氢气,排尽装置中的空气,再点燃酒精灯进行实验,反应结束时先撤酒精灯,冷却后再停止通氢气,所以连接顺序为baecd,故答案为:baecd;
②根据实验目的分析,后面试管中是过氧化钠与氢气反应,为了防止水蒸气与过氧化钠反应,所以要干燥氢气,则B装置内应放的试剂是固体干燥剂碱石灰;C装置是防止空气中的水蒸气和二氧化碳进入与过氧化钠,所以C装置中是碱石灰吸收空气中的二氧化碳和水蒸气;
故答案为:碱石灰;吸收H2中的H2O(g)、HCl,防止与Na2O2反应对实验有干扰;吸收空气中的水蒸气、CO2,防止气体进入试管与Na2O2反应;
③装置C中,通氢气进入试管内的导管应该伸到试管底部,其图象为: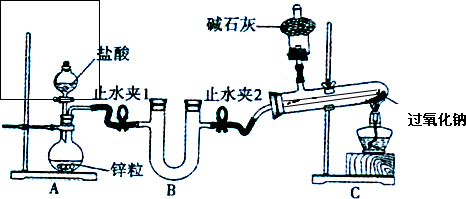 ;
;
故答案为: ;
;
④已知Na2O2+H2→NaOH,过氧化钠为淡黄色固体,氢氧化钠为白色固体,所以淡黄色固体变成白色固体,
故答案为:淡黄色固体变成白色固体;
⑤过氧化钠能与水反应生成氧气,所以要检验没有过氧化钠,则加水即可,若没有氧气生成,则证明Na2O2完全反应;
故答案为:取下装置C中试管,向试管中加入少量蒸馏水,没有气泡产生,证明Na2O2完全反应.
②Na2O2+H2→Na+H2O,Na具有强还原性,氢气不能置换生成Na,所以不可能;
③Na2O2+H2→Na2O+H2O,Na2O与H2O会反应生成氢氧化钠,所以不可能;
④Na2O2+H2→NaH+O2,H2是常用的还原剂,反应中作氧化剂,所以不可能;
⑤Na2O2+H2→NaOH+O2,反应物中氢元素和氧元素化合价都升高,不符合氧化还原反应原理,
⑥Na2O2+H2→NaOH+H2O,已知Na2O2是一种强氧化剂,H2是常用的还原剂,所以二者反应可能生成NaOH,若有水则过氧化钠会与氧气会生成氧气,所以不可能;
故答案为:①;
(2)①根据连接仪器的一般顺序分析,先检验气密性再加药品,先通入氢气,排尽装置中的空气,再点燃酒精灯进行实验,反应结束时先撤酒精灯,冷却后再停止通氢气,所以连接顺序为baecd,故答案为:baecd;
②根据实验目的分析,后面试管中是过氧化钠与氢气反应,为了防止水蒸气与过氧化钠反应,所以要干燥氢气,则B装置内应放的试剂是固体干燥剂碱石灰;C装置是防止空气中的水蒸气和二氧化碳进入与过氧化钠,所以C装置中是碱石灰吸收空气中的二氧化碳和水蒸气;
故答案为:碱石灰;吸收H2中的H2O(g)、HCl,防止与Na2O2反应对实验有干扰;吸收空气中的水蒸气、CO2,防止气体进入试管与Na2O2反应;
③装置C中,通氢气进入试管内的导管应该伸到试管底部,其图象为:
 ;
;故答案为:
 ;
;④已知Na2O2+H2→NaOH,过氧化钠为淡黄色固体,氢氧化钠为白色固体,所以淡黄色固体变成白色固体,
故答案为:淡黄色固体变成白色固体;
⑤过氧化钠能与水反应生成氧气,所以要检验没有过氧化钠,则加水即可,若没有氧气生成,则证明Na2O2完全反应;
故答案为:取下装置C中试管,向试管中加入少量蒸馏水,没有气泡产生,证明Na2O2完全反应.
点评:本题考查了过氧化钠与氢气的探究实验,注意从化合价的角度分析可能的产物,注意过氧化钠的性质能与水及二氧化碳反应,题目难度中等.

练习册系列答案
相关题目








 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。