题目内容
【题目】固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H= -49.0 kJ/mol
CH3OH(g)+H2O(g) △H= -49.0 kJ/mol
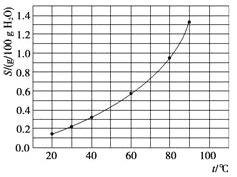
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)该反应在_____条件下能自发进行(填编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0~8 min内CO2的平均反应速率是_________mol/(Lmin)。
(3)该反应的平衡常数K=_______。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是__________,曲线Ⅱ改变的条件可能是_______________。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是______________。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
【答案】B 0.125 mol/(Lmin) 0.5 升高温度 增大压强 K1<K2=K BD
【解析】
(1)根据反应的自由能△G=△H-T△S<0分析;
(2)先计算0~8 min内H2的平均反应速率,然后利用速率关系计算;
(3)根据化学平衡常数的定义书写计算。
(4)虚线I达到平衡时间比实线短,且平衡时n(H2)物质的量多;根据外界条件对化学反应速率和化学平衡的影响因素分析。
根据化学平衡常数只与温度有关,结合该反应的正反应是放热反应,升高温度,平衡逆向移动,化学平衡常数减小分析。
(5)根据外界条件对化学反应速率、化学平衡的影响及定义分析判断。
(1)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H= -49.0 kJ/mol若要自发进行,△G=△H-T△S<0,由于△H<0,△S<0,要使△H-T△S<0,则反应的温度T<0,故合理选项是B。(2)根据图示可知在0~8 min内H2的平均反应速率v(H2)=
CH3OH(g)+H2O(g)△H= -49.0 kJ/mol若要自发进行,△G=△H-T△S<0,由于△H<0,△S<0,要使△H-T△S<0,则反应的温度T<0,故合理选项是B。(2)根据图示可知在0~8 min内H2的平均反应速率v(H2)= mol/(L·min),根据方程式可知v(CO2):v(H2)=1:3,所以v(CO2)=
mol/(L·min),根据方程式可知v(CO2):v(H2)=1:3,所以v(CO2)=![]() v(H2)=
v(H2)=![]() ×
×![]() mol/(L·min)=0.125 mol/(L·min);
mol/(L·min)=0.125 mol/(L·min);
(3)在反应开始时,n(H2)=8mol,n(CO2)=6mol,达到平衡时n(H2)=2mol,反应消耗了6mol,所以根据反应方程式中物质转化关系可知:CO2反应消耗2mol,平衡时n(CO2) =4mol,n(CH3OH)=2mol,n(H2O)=2mol,容器的容积为2L,则各物质的平衡浓度:c(H2)=![]() =1mol/L,c(CO2) =2mol/L,c(CH3OH)=c(H2O)=1mol/L,由于化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以该反应的平衡常数K=
=1mol/L,c(CO2) =2mol/L,c(CH3OH)=c(H2O)=1mol/L,由于化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以该反应的平衡常数K=![]() =0.5;
=0.5;
(4)虚线I达到平衡时间比实线短,说明反应速率快,且平衡时n(H2)物质的量多,说明改变条件使平衡逆向移动又可以提高反应速率,可能是升高反应温度;
虚线II达到平衡时间比实线短,说明反应速率快,且平衡时n(H2)物质的量减少,说明改变条件使平衡正向移动又可以提高反应速率,可能是增大体系的压强;
化学平衡常数只与温度有关,温度不变,化学平衡常数不变,由于I是升高温度,该反应的正反应是放热反应,升高温度,平衡逆向移动,化学平衡常数减小,所以K1<K;反应II是增大压强,反应温度不变,化学平衡常数不变,因此K2=K,所以化学平衡常数的关系是K1<K2=K;
(5)A.化学反应速率是衡量化学反应进行的快慢程度的物理量,所以化学反应速率理论可指导我们在一定时间内快出产品,多出产品,选项A正确;
B.能够发生化学反应的碰撞为有效碰撞,所以有效碰撞理论可指导怎样使化学反应速率加快,与如何提高原料的转化率无关,选项B错误;
C.勒夏特列原理也就是化学平衡移动原理,可指导怎样使用有限原料多出产品,提高原料转化率,选项C正确;
D.催化剂的使用可提高反应速率,由于对正、逆反应速率影响相同,因此不能提高产率,选项D错误;
E.正确利用化学反应速率和化学反应限度可以尽快达到化学平衡,使化学平衡向有利于生产产品的方向进行,因此都可以达到提高化工生产的综合经济效益的目的,选项E正确;
答案选BD。

 备战中考寒假系列答案
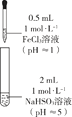
备战中考寒假系列答案【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
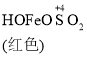
![]()
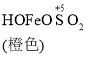
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象