题目内容
4.化学与社会、生产、生活密切相关.下列说法不正确的是( )| A. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| B. | 石油分馏可得到石油气、汽油、煤油、柴油等 | |
| C. | “海水淡化”可以解决“淡水供应危机”,加入明矾可以使海水淡化 | |
| D. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 |
分析 A.加热能使蛋白质变性;
B.石油分馏是依据物质沸点不同将石油分成不同沸点范围段馏分;
C.明矾不能淡化海水;
D.沉淀向Ksp更小的方向转化.
解答 解:A.加热能使蛋白质变性,采用加热消毒的目的是使蛋白质变性而杀灭细菌消毒,故A正确;
B.石油分馏是将石油分成沸点段不同的产物,通过分馏可得到石油气、汽油、煤油、轻柴油等馏分,故B正确;
C.明矾可水解生成氢氧化铝胶体,具有吸附性,可除去水中的悬浮物而净化水,但不能使海水淡化,故C错误;
D.沉淀向Ksp更小的方向转化,加入MnS可使Cd2+离子转化为CdS沉淀,故D正确.
故选C.
点评 本题考查了蛋白质的性质,石油的深加工,明矾净水以及沉淀转化等,属于化学在生活、生产中的应用,题目简单,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下表是元素周期表的一部分,完成下列有关问题:
(1)在这些元素中,最活泼的金属元素是K(填元素符号或化学式,下同),最活泼的非金属元素是F,最不活泼的元素是Ar.
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在③和④中,化学性质较活泼的是Na,怎样用化学实验证明?答:与H2O反应.在⑧与⑫中,化学性质较活泼的是Cl,怎样用化学实验证明?答:单质间的置换反应(氯气能置换出NaBr中的Br生成溴单质).
15. 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
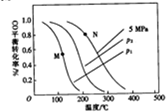
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
 中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)
中国科学院大连化学物理研究所的“甲醇制取低碳烯烃(DMTO)技术”获2014年度国家技术发明一等奖,该技术是先由煤气化制取合成气,再由合成气制取甲醇)1)煤气化包含一系列化学反应,已知:
C(s)+H2O(g)=CO(g)+H2(g)△H1=+131.3kJ•mol-1,
C(s)+CO2(g)=2CO(g))△H2=+172kJ•mol-1;
则反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H3=-40.7kJ•mol-1;
(2)以投料比$\frac{n({H}_{2})}{n(CO)}$=2制取甲醇,发生反应,CO(g)+2H2(g)=CH3OH(g)△H,温度、压强与CO的平衡转化率关系如下图所示:
①△H<0,P1<P2,(填“>”或“<”)
②比较图中M、N两点对应温度下反应的平衡常数大小:K(M)>(填“>”或“<”或“=”)K(N)
③若提高起始时的投料比[$\frac{n({H}_{2})}{n(CO)}$],则CO的平衡转化率将增大(填”增大““减小”或“不变”).
④实际工业生产中大多采用的条件为5MPa和230~270℃,由下表可知其优点是低压法所需设备要求低,副反应少,催化剂易再生.
| 方法 | 催化剂 | 条件 | 备注 | 特点 | |
| 压力/MPa | 温度/℃ | ||||
| 高压法 | ZnO-Cr2O3 二元催化剂 | 25-30 | 380-400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
| 低压法 | CuO-ZnO-Al2O3 三元催化剂 | 5 | 230-270 | 1966年工业化 | (1)催化剂易中毒,再生容易 (2)副反应少 |
12.小强用托盘天平称5.0克食盐,当指针不在分度盘中央而偏右时,就开始称量.称量后天平达到平衡时(指针在分度盘中央),则实际称量的食盐的质量( )
| A. | 等于5.0克 | B. | 小于5.0克 | C. | 大于5.0克 | D. | 无法判断 |
9.下列有关化学实验的叙述正确的是( )
| A. | 为了增强高锰酸钾溶液的氧化能力,用稀盐酸将高锰酸钾溶液进行酸化 | |
| B. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 |
16.某有机物的结构简式为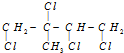 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
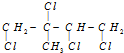 ,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )
,它是由某烃和Cl2充分加成所得到的产物,则原有机物一定是( )| A. | 2-丁炔 | B. | 2-甲基-1,3-丁二烯 | ||
| C. | 1,3-丁二烯 | D. | 1,4-二氯-2-甲基-2-丁烯 |
14.X、Y、Z为短周期元素,X原子最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z的最外层电子数是内层电子总数的三倍.有关下列叙述正确的是( )
| A. | X、Y、Z三种元素可形成化合物X3YZ4 | |
| B. | X、Y两元素形成的化合物只可能为离子化合物 | |
| C. | Y、Z两元素形成的化合物均会对空气造成污染 | |
| D. | 稳定性:Y的氢化物大于Z的氢化物 |
 某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.
某校研究性学习小组到实验室进行探究实验.他们准备用加热高锰酸钾的方法制取氧气并验证氧气的性质.