题目内容
15.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | 3.0 L 0.1 mol•L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-) | |
| C. | 常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,则原醋酸溶液醋酸的电离度为1% | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
分析 A.溶液增重的为二氧化碳的质量,根据n=$\frac{m}{M}$计算出二氧化碳的物质的量,再根据n=cV计算出NaOH的物质的量,根据计算结果判断反应产物,然后根据碳酸钠、碳酸氢钠的物质的量判断溶液中离子浓度大小;
B.混合液为中性,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-)+c(Cl-),由于加入的氯化氢较少,则c(CH3COO-)>c(Cl-),再结合物料守恒可得c(Cl-)=c(CH3COOH);
C.二者等体积混合恰好反应,则根据氢氧化钠的浓度可知醋酸的浓度,根据醋酸的pH可计算出醋酸电离出的氢离子浓度,从而可计算出醋酸的电离度;
D.根据混合液中的物料守恒判断.
解答 解:A.溶液增重的质量为二氧化碳,.0 L 0.1 mol•L-1,n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,NaOH溶液中含有氢氧化钠的为:n(NaOH)=0.1mol/L×3.0L=0.3mol,1<$\frac{n(NaOH)}{n(C{O}_{2})}$=1.5<2,所以二者反应生成的是NaHCO3和Na2CO3,设n(Na2CO3)=xmol、n(NaHCO3)=ymol,根据C原子、Na原子守恒得:x+y=0.2、2x+y=0.3,解得:x=0.1、y=0.1,故反应后生成等物质的量的NaHCO3和Na2CO3,碳酸钠的水解程度大于碳酸氢钠,则:c(CO32-)<c(HCO3-),正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故A错误;
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7,则c(H+)=c(OH-),根据电荷守恒可知:①c(Na+)=c(CH3COO-)+c(Cl-),由于加入的氯化氢较少,则c(CH3COO-)>c(Cl-),溶液中满足物料守恒:②c(Na+)=c(CH3COO-)+c(CH3COOH),根据①②可得:c(Cl-)=c(CH3COOH),所以溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-),故B正确;
C.常温下,pH=3的醋酸溶液和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,说明醋酸和NaOH的物质的量浓度相等,pH=3的溶液中醋酸电离的c(H+)≈0.001mol/L,pH=13的氢氧化钠溶液的浓度为0.1mol/L,则原溶液中c(CH3COOH)=c(NaOH)=0.1mol/L,则原醋酸溶液醋酸的电离度为:$\frac{0.001mol/L}{0.1mol/L}$×100%=1%,故C正确;
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中,根据物料守恒可得:2c(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D错误;
故选BC.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒、盐的水解原理的含义及判断离子浓度大小常用方法.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 分子式为C7H8O,且属于芳香族化合物的同分异构体只有4种 | |
| B. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物最多有6种 | |
| C. | 丙烷的一氯代物有2种,丙烷的二氯代物有4种 | |
| D. | 联苯(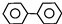 )的一氯代物有3种,二氯代物有12种 )的一氯代物有3种,二氯代物有12种 |

Ⅱ:为了研究同周期元素性质递变规律,某同学设计了如下实验方案:
(1)表中的“实验步骤”与“实验现象”前后不是对应关系的是:①②
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 镁浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 | 有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | 剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 | 反应不十分剧烈;产生无色气体 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 | 生成白色胶状沉淀,继而沉淀消失 |
Ⅲ:某实验小组欲探究碳与浓硝酸反应的情况.甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应.
(1)甲同学的实验应该在通风橱中进行,才符合化学实验安全性的要求.
(2)乙同学认为红棕色气体不一定是碳与浓硝酸发生反应而得,可能是浓硝酸受热分解产生的红棕色气体,请写出浓硝酸受热分解的化学方程式4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,所以他认为应该检验CO2(填化学式)的产生来证明碳与浓硝酸反应.为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示.
(3)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是②.
①将木炭与浓硝酸一同放在装置中加热;②先加热木炭,再将木炭投入冷浓硝酸;
③先加热木炭,再加入冷浓硝酸;④先加热浓硝酸,然后将木炭投入其中.
(4)请用平衡移动原理解释B装置的作用常温下存在平衡体系:2NO2?N2O4,降低温度N2O4液化,平衡右移,除去混合气体中的NO2(结合方程式与文字表述).
(5)若同意碳与浓硝酸反应生成二氧化氮的观点.将C装置所得的悬浊液过滤、洗涤、干燥、冷却、称量,所得固体质量为m克,则被还原的HNO3的质量为:$\frac{4×63×m}{197}$g(列出计算表达式即可).(忽略空气中二氧化碳的影响.相对原子质量:H 1 C 12 N 14 O 16 Ba 137)
| 序 号 | 实 验 目 的 | 答案 | 供选择的化学试剂及方法 |
| (1) | 实验室检验二氧化碳气体 | F | A让激光透过 B 滴入无色KSCN溶液 C抽少许纱,灼烧 D新制的Cu(OH)2,加热 E通过盛溴水的洗气瓶 F通入澄清石灰水中 |
| (2) | 鉴别溶液和胶体 | A | |
| (3) | 化验糖尿病 | D | |
| (4) | 鉴别Fe2+和Fe3+ | B | |
| (5) | 识别棉织品和毛织品 | C |
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
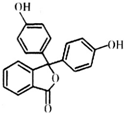 酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )
酚酞医药名为果桃,可治疗消化系统疾病,其有效成分的结构简式如图所示.下列对该有效成分的说法正确的是( )| A. | 所有原子可能共平面 | |
| B. | 能发生加聚反应生成高分子化合物 | |
| C. | 酚酞的水解产物中含有醇羟基 | |
| D. | 1 mol该物质最多能与含4 mol NaOH的烧碱溶液反应 |
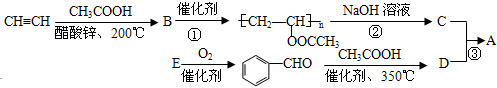
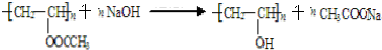 ;反应类型是取代反应.
;反应类型是取代反应. .
.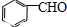 能发生银镜反应,该反应的化学方程式是
能发生银镜反应,该反应的化学方程式是 .
.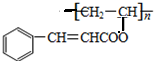 ,关于A的性质下列说法正确的是acd(填字母).
,关于A的性质下列说法正确的是acd(填字母).

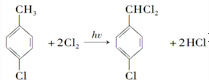 ;该反应的类型为取代反应.
;该反应的类型为取代反应. .
.