题目内容
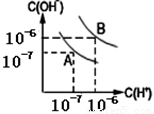
水的电离平衡如图1-2-13所示: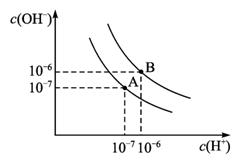
图1-2-13
(1)若A点表示25℃时水的电离平衡状态,当温度升高至100℃时水的电离平衡状态为B点,则此时水的离子积从_________增加到_________。
(2)将100℃ pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃恒温,欲使混合液的pH=7,则Ba(OH)2与盐酸的体积比为_________。
(3)向纯水中加入NaHSO4(温度不变)则溶液的_________。
A.pH升高 B.pH降低
C.c(H+)·c(OH-)增大 D.c(H+)>c(OH-)
解析:本题主要考查外界条件对水的电离平衡的影响及确定不同温度下水的离子积。
(1)在25℃时:
KW=1×10-7×1×10-7=1×10-14
在100℃时:
KW=1×10-6×1×10-6=1×10-12
(2)在100℃时pH=7,呈碱性。设Ba(OH)2与盐酸的体积分别为V1、V2,则
10-5 mol·L-1=![]()
化简得:![]()
水是一种极弱的电解质,在一定温度下达到电离平衡:H2O![]() H++OH-。NaHSO4
H++OH-。NaHSO4
![]() Na++H++
Na++H++![]() ,c(H+)增加,所以c(H+)>c(OH-)。因此应选B、D。
,c(H+)增加,所以c(H+)>c(OH-)。因此应选B、D。
答案:(1)1×10-14 1×10-12 (2)2∶9 (3)BD

(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n?c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
| A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(CO32-)=c(HCO3-)+c(H2CO3) |
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示)
 。
。④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。