题目内容
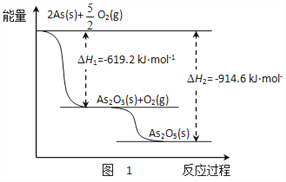
【题目】氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3﹣ , 两步反应的能量变化示意图如图所示: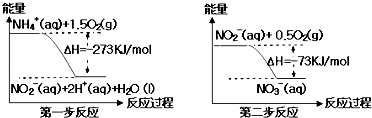
下列说法合理的是( )
A.该反应的催化剂是NO2﹣
B.升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3﹣
C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态
D.1 mol NH4+在第一步反应中与1 mol NO2﹣在第二步反应中失电子数之比为1:3
【答案】C
【解析】A、NO2﹣在第一步反应中是生成物,在第二步反应中是反应物,为中间产物,不符合催化剂的定义,A不符合题意;
B、分析两步反应可知:两步反应均为放热反应,升高温度,不利于NH4+转化成NO3﹣,B不符合题意;
C、第一步反应中有氢离子生成,氢离子存在抑制水的电离,当水的电离不变时,说明氢离子浓度不变,可说明此反应达到平衡状态,C符合题意;
D、NH4+ 转化成NO3﹣转移电子数为5﹣(﹣3)=8,NO2﹣转化为NO3﹣,转移电子数为5﹣(3)=2.转移电子数之比为4:1,D不符合题意;
所以答案是:C
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.

练习册系列答案
相关题目