题目内容
13.已知反应2HBr(g)?Br2(g)+H2(g),在四种不同的条件下进行,Br2、H2起始的浓度为0,反应物HBr的浓度(mol/L)随反应时间(min)的变化情况如下表:| 实验序号 | 实验温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.5 | 0.5 | 0.5 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A. | 从上表数据分析,2HBr?Br2+H2正反应为放热反应 | |
| B. | 实验2中HBr的初始浓度C2=1.0 mol/L | |
| C. | 实验3的反应速率小于实验1的反应速率 | |
| D. | 实验4一定使用了催化剂 |
分析 A.根据实验1、4数据分析;
B.根据实验1、2数据分析;
C.以10至20min为例求出反应速率进行比较;
D.根据催化剂能加快化学反应速率,能减少到达平衡的时间,但平衡不移动.
解答 解:A.根据实验1、4数据分析,起始浓度相等,实验4达平衡后HBr的物质的量浓度偏小,升高温度平衡向吸热的方向移动,即正反应方向移动,所以2HBr?Br2+H2正反应为吸热反应,故A错误;
B.根据实验1、2数据分析,温度相同,达平衡后HBr的物质的量浓度相同,Br2、H2起始的浓度为0,所以两组实验中HBr的起始浓度相同为1.0mol•L-1 ,故B正确;
C.在实验1中,反应在10至20min时间内平均速率为V=$\frac{0.80moL/L-0.67moL/L}{10min}$=0.013mol•(L•min)-1,在实验3中,反应在10至20min时间内平均速率为V=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,所以v3>v1,故C错误;
D.实验4到达平衡的时间短,平衡后HBr的物质的量浓度偏小,平衡发生移动,所以不可能使用催化剂,故D错误;
故选:B.
点评 本题考查了化学平衡的分析判断,化学反应速率的计算应用,注意影响平衡因素的分析判断条件,题目难度中等.

练习册系列答案
相关题目
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等质量的丙烯(C3H6)和环丁烷(C4H8)所含有的原子数一定相等 | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 将5.85g NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA |
4. 称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
 称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )
称取Na2CO3、NaHCO3固体各2g,分别加入两只大试管中,再各加10mL蒸馏水,充分溶解后各滴入2滴酚酞溶液,观察到如图所示现象.下列说法中正确的是( )| A. | 试管a溶解过程中温度下降 | |
| B. | 试管b中放入的是NaHCO3固体 | |
| C. | 两试管中水的离子积常数:a<b | |
| D. | 对比液体颜色可知常温下水解程度:CO32->HCO3- |
1.科学家将${\;}_{30}^{66}$Zn和${\;}_{82}^{208}$Pb两原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267.下列有关该元素的说法正确的是( )
| A. | 位于第七周期第Ⅷ族 | |
| B. | 具有“两性” | |
| C. | 原子核外共有6个电子层 | |
| D. | 该原子中,中子数与质子数之差为43 |
8.下列有关环境方面的说法不正确的是( )
| A. | 绿色化学的核心是应用化学原理治理产生的环境污染 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 采用天然石材装修家居,可减轻室内甲醛污染但会导致一定量的放射性物质的污染 | |
| D. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
18.丁香酚是一种有特殊香味的液体,它的结构简式是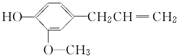 ,丁香酚不具有的性质是( )
,丁香酚不具有的性质是( )
 ,丁香酚不具有的性质是( )
,丁香酚不具有的性质是( )| A. | 与金属钠反应 | B. | 与NaOH溶液反应 | ||
| C. | 与碳酸钠反应放出CO2 | D. | 能发生加成反应 |
2.下列化学反应中,属于放热反应的是( )
| A. | Al+稀盐酸 | B. | Ba(OH)2•8H2O+NH4Cl(固体) | ||
| C. | KClO3受热分解 | D. | C和CO2反应 |
3.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X、W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A. | 离子的氧化性:Y>Z | B. | 氢化物的沸点:X<W | ||
| C. | X、W最高正价相同 | D. | 原子及离子半径:Z>Y>X |
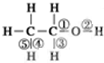 乙醇分子中化学键如图:
乙醇分子中化学键如图: