题目内容
10.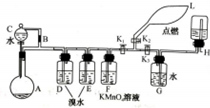 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:①检验X气体能否被KMnO4酸性溶液氧化;
②用L收集X气体,并做燃烧实验;
③将多余的X气体储存起来,以便以后进行其他实验.
(1)写出装置A中制取X气体的化学方程式Al4C3+12H2O═4Al(OH)3+3CH4↑;
(2)装置D的作用是(用有关化学方程式表示)除去丙炔;
(3)根据什么现象判断X不能被酸性KMnO4溶液氧化?F瓶中紫色未退色;
(4)导管B的作用是平衡压强,使液体顺利流下,同时防止分液漏斗漏气;
(5)X燃烧现象是产生淡蓝色的火焰,无黑烟;
(6)储存多余的X气体的操作方法是关闭k2,打开k14,在G中用排水法收集甲烷.
分析 (1)Al4C3与水反应生成氢氧化铝和甲烷;
(2)制备的气体中含有丙炔,丙炔能够与溴水发生加成反应而除去;
(3)甲烷性质稳定,不能被酸性的高锰酸钾氧化;
(4)导管B将烧瓶与分液漏斗连接,起到平衡压强,使液体顺利流下,同时防止分液漏斗漏气的作用;
(5)甲烷能燃烧产生淡蓝色火焰,因为其含碳量低,所以不会产生黑烟;
(6)要想储存多于的氯气需要关闭k2,打开k14,在G中用排水法收集甲烷.
解答 解:(1)Al4C3与水反应生成氢氧化铝和甲烷,化学方程式:Al4C3+12H2O═4Al(OH)3+3CH4↑;
故答案为:Al4C3+12H2O═4Al(OH)3+3CH4↑;
(2)因为Al4C3(含少量Mg2C3杂质)与水反应除了生成甲烷外还有少量的丙炔,丙炔能够与溴水发生加成反应而除去,方程式为:CH3-C≡CH|+Br2→CH3-CBr2-CHBr2;
故答案为:CH3-C≡CH|+Br2→CH3-CBr2-CHBr2;
(3)甲烷性质稳定,不能被酸性的高锰酸钾氧化,所以F中溶液不会退色;
故答案为:F瓶中紫色未退色;
(4)导管B将烧瓶与分液漏斗连接,起到平衡压强,使液体顺利流下,同时防止分液漏斗漏气的作用;
故答案为:平衡压强,使液体顺利流下,同时防止分液漏斗漏气;
(5)甲烷燃烧的现象:产生淡蓝色的火焰,无黑烟;
(6)要想储存多于的氯气需要关闭k2,打开k14,在G中用排水法收集甲烷,
故答案为:关闭k2,打开k14,在G中用排水法收集甲烷.
点评 本题考查了甲烷的制备和除杂,熟悉物质的化学性质、制备原理是解题关键,题目难度中等.

练习册系列答案
相关题目
17.下列对各组物质性质的比较中,正确的是( )
| A. | 硬度:Li>Na>K | |
| B. | 熔点:金刚石>晶体硅>二氧化硅>碳化硅 | |
| C. | 第一电离能:Na<Mg<Al | |
| D. | 空间利用率:六方密堆<面心立方<体心立方 |
18.某微粒的结构示意图为 它表示( )
它表示( )
 它表示( )
它表示( )| A. | 钠离子 | B. | 氧离子 | C. | 氖原子 | D. | 氧原子 |
2.下列物质一定属于同系物的是( )


| A. | ⑦⑧ | B. | ⑤⑦ | C. | ①②③ | D. | ④⑥⑧ |
19.下列离子方程式书写正确的是( )
| A. | 氧化铜与盐酸反应 O2-+2H+═H2O | |
| B. | 碳酸氢钠溶于盐酸:HCO3-+H+=H2O+CO2↑ | |
| C. | 硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- | |
| D. | 石灰石溶于硝酸:CO32-+2H+=H2O+CO2↑ |
20.下列实验现象与对应结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入新制氯水,再向溶液中加入KSCN溶液 | 溶液变红色 | 该溶液中含有Fe2+ |
| D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
| A. | A | B. | B | C. | C | D. | D |