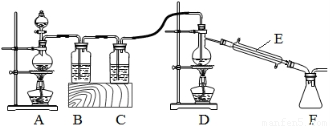
题目内容
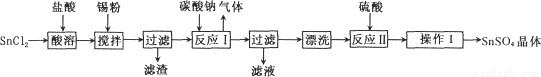
酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备的工艺流程如下:
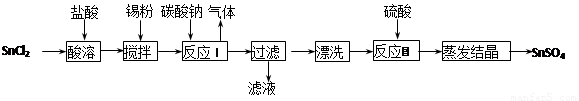
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是 ,加入锡粉的作用是 。
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
。
(3) 检验沉淀已经“洗涤”干净的操作是: 。
(4)反应II硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L-1,则室温下应控制溶液pH 。(已知:Ksp[Sn(OH)2]=1.0×10-26)
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因: 。
(16分)
(1)抑制Sn2+水解(2分) 防止Sn2+被氧化(2分)
(2)SnCl2 + Na2CO3 = SnO↓ + CO2↑+2NaCl(2分)
(3)取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净。(3分)
(4)小于1 (3分。若写成≤1给1分)
(5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O(2分)
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化。(2分)
【解析】
试题分析:(1)SnCl2是强酸弱碱盐,能水解,即SnCl2+2H2O Sn(OH)2+2HCl,直接用水溶解或稀释能促进Sn2+水解,用盐酸溶解,增大氢离子或氯化氢浓度使水解平衡向逆反应方向移动,即抑制Sn2+水解;读图可知,目标产物是SnSO4,其中所含锡元素的化合价为+2价,已知锡在水溶液中有Sn2+、Sn4+,说明加入锡粉的主要目的是防止Sn2+氧化为Sn4+或者将Sn4+还原为Sn2+;(2)Na2CO3与HCl容易发生反应,生成NaCl、H2O和CO2气体,促进SnCl2水解,生成的Sn(OH)2易分解为SnO沉淀和水,根据工艺流程图顺推和逆推,反应I的反应物为SnCl2、Na2CO3,生成物为SnO、NaCl、CO2,由于没有元素化合价变化,则反应I属于复分解反应,根据质量守恒定律,则SnCl2+Na2CO3=SnO↓+CO2↑+2NaCl;(3)由于沉淀具有较强的吸附性,则SnO沉淀中吸附了可溶性的NaCl和过量的Na2CO3,因此检验沉淀已经洗涤干净的方法是设计焰色反应不是黄色或检验氯离子或碳酸根离子的实验方案,最简单合理的操作是取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净;(4)由于Sn(OH)2(s)
Sn(OH)2+2HCl,直接用水溶解或稀释能促进Sn2+水解,用盐酸溶解,增大氢离子或氯化氢浓度使水解平衡向逆反应方向移动,即抑制Sn2+水解;读图可知,目标产物是SnSO4,其中所含锡元素的化合价为+2价,已知锡在水溶液中有Sn2+、Sn4+,说明加入锡粉的主要目的是防止Sn2+氧化为Sn4+或者将Sn4+还原为Sn2+;(2)Na2CO3与HCl容易发生反应,生成NaCl、H2O和CO2气体,促进SnCl2水解,生成的Sn(OH)2易分解为SnO沉淀和水,根据工艺流程图顺推和逆推,反应I的反应物为SnCl2、Na2CO3,生成物为SnO、NaCl、CO2,由于没有元素化合价变化,则反应I属于复分解反应,根据质量守恒定律,则SnCl2+Na2CO3=SnO↓+CO2↑+2NaCl;(3)由于沉淀具有较强的吸附性,则SnO沉淀中吸附了可溶性的NaCl和过量的Na2CO3,因此检验沉淀已经洗涤干净的方法是设计焰色反应不是黄色或检验氯离子或碳酸根离子的实验方案,最简单合理的操作是取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净;(4)由于Sn(OH)2(s)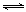 Sn2++2OH-,则Ksp[Sn(OH)2]=c(Sn2+)•c2(OH-),即c2(OH-)= Ksp[Sn(OH)2]/c(Sn2+),c(OH-)=
1.0×10-13mol/L;由于Kw= c(H+)•c(OH-)= 1.0×10-14,则c(H+)= Kw/c(OH-)= 1.0×10-1 mol/L,则pH=—lg c(H+)=1;为了防止析出Sn(OH)2沉淀,必须使溶液中Qc[Sn(OH)2]<Ksp[Sn(OH)2],则c(OH-)
<1.0×10-13mol/L,即c(H+)>1.0×10-1
mol/L,pH<1;(5)双氧水具有氧化性,能将锡元素从+2价氧化为+4价,而过氧化氢被还原为水,根据最小公倍数法配平,由电子、电荷和原子守恒可得:Sn2+ + H2O2 +
2H+ = Sn4+ + 2H2O;(6)金属活动顺序表中锡位于铜前,构成原电池时,锡是负极,铜是正极,则锡被腐蚀,铜被保护,即使锡层破损也能防止铜腐蚀,这是牺牲阳极的阴极保护法的应用。
Sn2++2OH-,则Ksp[Sn(OH)2]=c(Sn2+)•c2(OH-),即c2(OH-)= Ksp[Sn(OH)2]/c(Sn2+),c(OH-)=
1.0×10-13mol/L;由于Kw= c(H+)•c(OH-)= 1.0×10-14,则c(H+)= Kw/c(OH-)= 1.0×10-1 mol/L,则pH=—lg c(H+)=1;为了防止析出Sn(OH)2沉淀,必须使溶液中Qc[Sn(OH)2]<Ksp[Sn(OH)2],则c(OH-)
<1.0×10-13mol/L,即c(H+)>1.0×10-1
mol/L,pH<1;(5)双氧水具有氧化性,能将锡元素从+2价氧化为+4价,而过氧化氢被还原为水,根据最小公倍数法配平,由电子、电荷和原子守恒可得:Sn2+ + H2O2 +
2H+ = Sn4+ + 2H2O;(6)金属活动顺序表中锡位于铜前,构成原电池时,锡是负极,铜是正极,则锡被腐蚀,铜被保护,即使锡层破损也能防止铜腐蚀,这是牺牲阳极的阴极保护法的应用。
考点:考查有关物质制备的化学工艺流程,涉及解释加入试剂的原因和作用、书写关键步骤的化学方程式、设计检验沉淀是否洗涤干净的实验方案、溶度积和水的离子积的有关计算、书写主要流程的离子方程式、根据原电池原理解释锡层破损也能防止铜腐蚀的原因等。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案