题目内容
(2009?泰州模拟)已知A是一种有机溶剂,F 是一种黄色晶体,N带有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16,A和B反应前后气体体积(常温常压)保持不变,在试管中灼烧固体I,试管底部无固体残留,反应①②③均是化工生产中的重要反应.
实验装置图

(1)A的结构式
(2)写出反应①的化学方程式
(3)高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式
该反应的平衡常数表达式K=
.
(4)请设计一个实验方案,完成反应④,并绘出实验装置图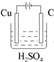
 .
.
实验装置图

(1)A的结构式
S=C=S
S=C=S
.(2)写出反应①的化学方程式
NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl
NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl
.(3)高温下反应⑤⑥互为可逆反应,写出反应⑥的化学方程式
3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
 Fe3O4+4H2
Fe3O4+4H23Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
, Fe3O4+4H2
Fe3O4+4H2该反应的平衡常数表达式K=
| c4(H2) |
| c4(H2O) |
| c4(H2) |
| c4(H2O) |
(4)请设计一个实验方案,完成反应④,并绘出实验装置图


分析:在试管中灼烧固体I,试管底部无固体残留,则说明I为铵盐,结合生成I的反应有NaCl参加,且为重要的工业反应,可说明该反应为侯氏制碱法的重要反应,则G为NaHCO3,I为NH4Cl,H为Na2CO3,F是一种黄色晶体,应为S,B为O2,D为SO2,J为SO3,符合J的相对分子质量比D大16,M为H2SO4,A是一种有机溶剂,含有S元素,应为CS2,符合A和B反应前后气体体积(常温常压)保持不变,则C为CO2,蓝色溶液为硫酸铜,则L为Cu,O为H2,N带有磁性,应为Fe3O4,K为H2O,P为Fe,结合对应的物质的性质以及题目要求可解答该题.
解答:解:在试管中灼烧固体I,试管底部无固体残留,则说明I为铵盐,结合生成I的反应有NaCl参加,且为重要的工业反应,可说明该反应为侯氏制碱法的重要反应,则G为NaHCO3,I为NH4Cl,H为Na2CO3,F是一种黄色晶体,应为S,B为O2,D为SO2,J为SO3,符合J的相对分子质量比D大16,M为H2SO4,A是一种有机溶剂,含有S元素,应为CS2,符合A和B反应前后气体体积(常温常压)保持不变,则C为CO2,蓝色溶液为硫酸铜,则L为Cu,O为H2,N带有磁性,应为Fe3O4,K为H2O,P为Fe,
(1)由以上分析可知A为CS2,结构式为S=C=S,故答案为:S=C=S;
(2)反应①侯氏制碱法的反应,化学方程式为NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl;
(3)反应⑥的化学方程式3Fe+4H2O(g) Fe3O4+4H2,平衡常数为 K=
Fe3O4+4H2,平衡常数为 K=
,故答案为:3Fe+4H2O(g) Fe3O4+4H2; K=
Fe3O4+4H2; K=
;
(4)完成反应④,应是铜作阳极,碳作阴极,电解质溶液为硫酸,装置为 ,故答案为:
,故答案为: .
.
(1)由以上分析可知A为CS2,结构式为S=C=S,故答案为:S=C=S;
(2)反应①侯氏制碱法的反应,化学方程式为NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl,故答案为:NaCl+CO2+H2O+NH3=NaHCO3↓+NH4Cl;
(3)反应⑥的化学方程式3Fe+4H2O(g)
 Fe3O4+4H2,平衡常数为 K=
Fe3O4+4H2,平衡常数为 K=| c4(H2) |
| c4(H2O) |
 Fe3O4+4H2; K=
Fe3O4+4H2; K=| c4(H2) |
| c4(H2O) |
(4)完成反应④,应是铜作阳极,碳作阴极,电解质溶液为硫酸,装置为
 ,故答案为:
,故答案为: .
.点评:本题考查无机物的推断,题目难度较大,注意以I为解答该题的突破口,结合物质的转化关系以及重要的工业用用途解答该题,注意相关物质的性质的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目




 由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得:
由甲苯与氯气在光照条件下反应生成,甲苯在工业上可通过下列流程获得: 请在括号中填写加工方法或操作名称
请在括号中填写加工方法或操作名称 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.
”表示氢原子,小黑点“?”表示没有形成共价键的最外层电子,短线表示共价键.