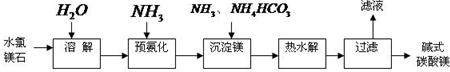
题目内容
有试剂A,B,C的水溶液,分别是Ba(NO3)2,CaCl2,AgNO3,HCl中的一种.
若使Na2CO3溶液与A恰好完全反应得到白色沉淀,过滤
在上述白色沉淀种加入B溶液,沉淀溶解并产生气体
在①所得溶液中加入C溶液又产生白色沉淀
根据上述试验结果,推断出A溶液是________,B溶液可能是________,
C溶液是________ 写出有关离子方程式________________.
CaCl2 HCl AgNO3 CO32-+2Ca2+=Ca CO3↓ CaCO3+2H+=CO2↑+Ca2++2H2O Cl-+Ag+=AgCl↓
分析:可以采用假设法:能和碳酸钠反应生成的白色沉淀中,碳酸钡、碳酸钙、碳酸银是溶于盐酸的沉淀,溶解的同时会生成二氧化碳,再根据①所得溶液中加入C溶液又产生白色沉淀,据此来判断反应产物是哪一种.
解答:根据题意:使Na2CO3溶液与A恰好完全反应得到白色沉淀,白色沉淀可以是碳酸钡、碳酸钙、或是碳酸银,只有一种情况使下面的结果是成立的,即使Na2CO3溶液与CaCl2恰好完全反应得到白色沉淀碳酸钙和氯化钠溶液,CO32-+Ca2+=CaCO3↓,白色沉淀碳酸钙中加入盐酸溶液,沉淀溶解并产生气体,CaCO3+2H+=CO2↑+Ca2++2H2O在①所得溶液氯化钠中加入硝酸银溶液又产生白色沉淀氯化银,Cl-+Ag+=AgCl↓,所以A溶液是氯化钙,B溶液可能是盐酸,C溶液是硝酸银,
故答案为:CaCl2;HCl;AgNO3;CO32-+2Ca2+=Ca CO3↓ CaCO3+2H+=CO2↑+Ca2++2H2O;Cl-+Ag+=AgCl↓.
点评:本题是一道物质鉴别题,注意离子检验和离子共存知识的灵活应用,平时知识的积累是解题关键,难度中等.
分析:可以采用假设法:能和碳酸钠反应生成的白色沉淀中,碳酸钡、碳酸钙、碳酸银是溶于盐酸的沉淀,溶解的同时会生成二氧化碳,再根据①所得溶液中加入C溶液又产生白色沉淀,据此来判断反应产物是哪一种.
解答:根据题意:使Na2CO3溶液与A恰好完全反应得到白色沉淀,白色沉淀可以是碳酸钡、碳酸钙、或是碳酸银,只有一种情况使下面的结果是成立的,即使Na2CO3溶液与CaCl2恰好完全反应得到白色沉淀碳酸钙和氯化钠溶液,CO32-+Ca2+=CaCO3↓,白色沉淀碳酸钙中加入盐酸溶液,沉淀溶解并产生气体,CaCO3+2H+=CO2↑+Ca2++2H2O在①所得溶液氯化钠中加入硝酸银溶液又产生白色沉淀氯化银,Cl-+Ag+=AgCl↓,所以A溶液是氯化钙,B溶液可能是盐酸,C溶液是硝酸银,
故答案为:CaCl2;HCl;AgNO3;CO32-+2Ca2+=Ca CO3↓ CaCO3+2H+=CO2↑+Ca2++2H2O;Cl-+Ag+=AgCl↓.
点评:本题是一道物质鉴别题,注意离子检验和离子共存知识的灵活应用,平时知识的积累是解题关键,难度中等.

练习册系列答案
相关题目
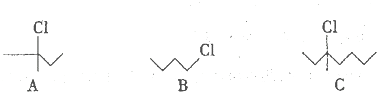
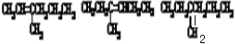
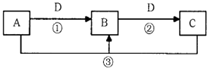 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空: