题目内容
KClO3与NaHSO3发生氧化还原反应生成Cl-和![]() 的速率如图所示,已知这个反应速率随着溶液中c(H+)的增大而加快.
的速率如图所示,已知这个反应速率随着溶液中c(H+)的增大而加快.
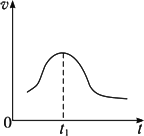
(1)反应开始时,反应速率加快的原因是_________________.
(2)反应后期时,反应速率下降的原因是_________________.
答案:
解析:
解析:
|
答案:(1)开始发生 (2)反应进行至t1时,因c(反应物)减小,且H++ 思路解析:由于KClO3与NaHSO3反应随c(H+)增大而加快,首先写出二者反应的化学方程式(或离子方程式 |

练习册系列答案
相关题目
下列说法正确的是( )
| A、KClO3和SO3溶于水后均能导电,故KClO3和SO3都是电解质 | B、常温下将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | C、常温下,等浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | D、25℃时,用pH=3的盐酸滴定等浓度的氨水至溶液的pH=7,V(氨水)<V(盐酸) |